Vol. 12 - Num. 48
Revisiones
Reproducción asistida y salud infantil
Roberto Ortiz Movillaa, Belén Acevedo Martínb
aUnidad de Neonatología. Servicio de Pediatría. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid. España.
bServicio de Ginecología y Obstetricia. Fundación Jiménez Díaz. Madrid. España.
Correspondencia: R Ortiz. Correo electrónico: rortizmovilla@telefonica.net
Cómo citar este artículo: Ortiz Movilla R, Acevedo Martín B. Reproducción asistida y salud infantil. Rev Pediatr Aten Primaria. 2010;12:651-71.
Publicado en Internet: 12-11-2010 - Número de visitas: 52189
Resumen
En los últimos años las gestaciones posibilitadas por técnicas de reproducción asistida han aumentado considerablemente. Con el aumento de parejas que se benefician de estas técnicas han surgido dudas acerca del efecto que podrían tener en la salud infantil y se han realizado diversos estudios para evaluar su seguridad y las posibles consecuencias a corto y largo plazo en los niños nacidos tras estos tratamientos. Con el aumento del desarrollo y la aplicación de estos procedimientos, el pediatra de Atención Primaria debe estar familiarizado con la terminología, indicaciones y técnicas que se realizan para facilitar la concepción, así como con los posibles riesgos y el impacto de las mismas en la salud pediátrica. En este artículo se revisarán en profundidad todos estos aspectos.
Palabras clave
● Fecundación in vitro ● Gestación múltiple ● Malformaciones congénitas ● Prematuridad ● Reproducción asistidaIntroducción
Desde que en 1978 naciera en el Reino Unido el primer niño concebido por fecundación in vitro (FIV), las técnicas de reproducción asistida (TRA) posibilitan el nacimiento de unos 100 000 niños al año en todo el mundo. Se estima que entre un 1% y un 4% de los niños nacidos anualmente en Estados Unidos y Europa son resultado de aplicar estos tratamientos1,2. En España, donde el primer nacimiento tras FIV tuvo lugar en 1984, el impacto de las TRA ha llevado a nuestro país a convertirse en el tercero de Europa con más procedimientos de este tipo, por detrás de Alemania y Francia. Con el extraordinario avance de estos tratamientos han surgido dudas en cuanto al impacto de las TRA en la salud infantil, no solo por el incremento de las tasas de gestaciones múltiples y de prematuridad que la aplicación de estas técnicas conlleva, sino porque se han generado incertidumbres acerca de posibles alteraciones genéticas, en el neurodesarrollo y en el pronóstico a largo plazo de los niños nacidos tras la aplicación de estos procedimientos3. No es infrecuente que en nuestra práctica diaria nos encontremos con pacientes nacidos tras TRA, o que sean los futuros padres los que nos consulten sobre el impacto de estos tratamientos en la salud de su hijo, por lo que los pediatras debemos estar familiarizados con la terminología, indicaciones y técnicas que se realizan para facilitar la gestación, así como con su influencia en la salud infantil a corto y largo plazo.
Estudio de la pareja estéril. Causas de infertilidad. Definiciones
La esterilidad se define como la incapacidad de uno o ambos miembros de la pareja para la concepción natural en un plazo razonable. En general, la especie humana posee una baja tasa de fecundidad, no superior al 30% mensual en una pareja menor de 30 años. Se asume que del total de la población en edad fértil, un 80% logrará la gestación en el plazo de los primeros 12 meses, y cerca de un 85% en 18 meses. Por ello, y en general, se puede afirmar que la imposibilidad de concebir tras un año de relaciones sexuales sin protección debe ser motivo para iniciar un estudio4,5. Este estudio está siendo continuamente sometido a revisión, ya que los avances que se producen en este tema han puesto en evidencia muchos de los procedimientos diagnósticos clásicamente utilizados. No es infrecuente que durante el mismo se descubran otras patologías de las que la esterilidad es sólo una de sus manifestaciones clínicas (endocrinopatías, malformaciones del aparato genital, tumores, endometriosis, cromosomopatías...). En términos generales, una vez confirmada la existencia de ovulación, la buena permeabilidad tubárica, y la presencia de una proporción suficiente de espermatozoides morfológica y funcionalmente normales, se podrá clasificar el problema de la pareja estudiada como esterilidad primaria (mujeres que nunca han tenido una gestación) o esterilidad secundaria, reservándose los términos de infertilidad (incapacidad para lograr un recién nacido viable tras haber logrado al menos dos embarazos consecutivos) o subfertilidad (incapacidad de conseguir una gestación espontánea en un periodo de tiempo superior al de la media de la población), como conceptos más amplios, menos restrictivos y más abiertos que el de esterilidad4. Además, se establecerá un diagnóstico etiológico de la esterilidad, que puede tener múltiples orígenes, desde alteraciones anatómicas hasta endocrinológicas pasando por otros problemas más complejos (inmunitarios, moleculares...). Por otro lado, y dejando de lado la posible existencia de algún problema anatómico o funcional, se sabe que, en la mujer, la edad condiciona de forma evidente su capacidad de reproducción, observándose claramente una disminución de esta a partir de los 35 años, que se acentúa más a partir de los 40 años. A esas edades, tanto la calidad ovocitaria como la capacidad del útero para llevar un embarazo a término se ven afectadas4,5. En la actualidad existen diferentes condicionantes sociales, culturales y laborales que han propiciado un acceso más tardío de la mujer a la maternidad, causa fundamental del aumento del número de tratamientos vivido en los últimos años.
Definiremos por tanto las técnicas de reproducción asistida como todos aquellos procedimientos destinados a auxiliar, transformar o sustituir procesos que de forma natural ocurren espontáneamente en el aparato genital femenino por medio de una manipulación médica, para permitir la concepción y el normal desarrollo de la gestación en parejas con problemas de fertilidad. Incluye todas las técnicas que requieran manipulación de óvulos o semen fuera del cuerpo humano6. Aunque las TRA fueron inicialmente desarrolladas para el tratamiento de enfermedades tubáricas, hoy en día se utilizan para tratar una gran variedad de causas de infertilidad (tabla 1). Una vez que se inicia el tratamiento de la pareja estéril se llevará a cabo alguno de los procedimientos que pasamos a describir a continuación.
Técnicas de reproducción asistida. Tipos
Inseminación artificial
La inseminación artificial (IA) se define como la introducción de espermatozoides de manera no natural en el aparato reproductor femenino con el objetivo de lograr una gestación. En un principio, esta técnica se utilizó en situaciones de alteración anatómica del aparato reproductor masculino o en casos de disfunción eréctil, en los que el varón no era capaz de eyacular dentro de la vagina de su pareja. Posteriormente se utilizó también en casos de infertilidad masculina –oligozoospermia (recuento total de espermatozoides inferior a 40 millones), astenozoospermia (menos de la mitad de los espermatozoides con movilidad o menos del 25% con buena progresión rectilínea)–, ya que al concentrar los espermatozoides se consigue que un mayor número de ellos alcance la periferia del ovocito. Hoy en día también se utiliza en casos de disfunción ovulatoria femenina, cuando existe factor cervical (alteraciones en la funcionalidad del cérvix, o presencia de anticuerpos anti-espermatozoides en el moco cervical que pueden ejercer una barrera para el paso de los espermatozoides), o en casos de endometriosis leve cuando aún está intacta la anatomía pélvica1,7.
Dependiendo del origen del semen, la IA puede ser homóloga o conyugal o con semen de donante, en los casos de infertilidad masculina grave, enfermedades genéticas en el varón o en mujeres sin pareja. Aunque en mujeres con ovulación normal se podría hacer IA sin necesidad de tratamiento hormonal que estimule la ovulación, esta estimulación ovárica mejora francamente las posibilidades de gestación, ya que permite controlar mejor el ciclo, hace que el endometrio sea más receptivo y, al haber más óvulos, logra que existan más posibilidades de que alguno de ellos sea fecundado por algún espermatozoide. Por otro lado, el semen masculino se somete a un proceso de capacitación artificial, que además de eliminar el plasma seminal, que podría producir reacciones alérgicas en caso de introducirse en el útero, realiza una incubación en medios específicos y en condiciones microambientales perfectas para mejorar la movilidad y poder separar y seleccionar los mejores espermatozoides del resto. Tras esta preparación seminal, y una vez decidido el momento óptimo para realizar la técnica, se introduce mediante una cánula fina una pequeña cantidad de semen dentro del útero.
Fecundación in vitro
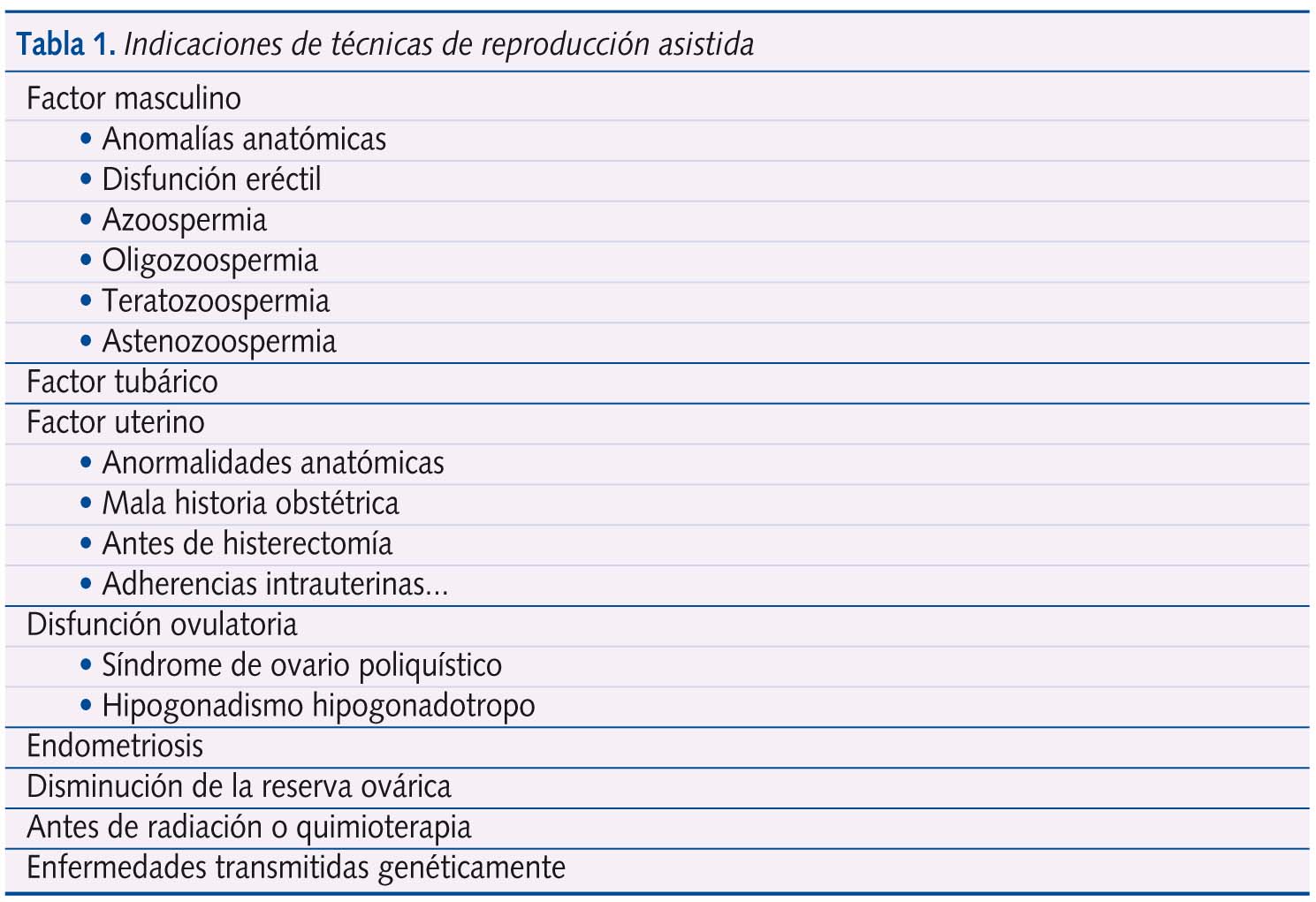
La fecundación in vitro (FIV) es uno de los tratamientos de más amplia aplicación dentro de las técnicas de reproducción asistida y constituye, junto con la microinyección espermática (ICSI), una de las técnicas de uso rutinario en el tratamiento de la infertilidad8. Este procedimiento consiste en la aspiración transvaginal de ovocitos para inseminarse con espermatozoides previamente preparados, proporcionar condiciones óptimas para la fertilización en el laboratorio, evaluar la división celular de los embriones y transferirlos en el momento oportuno por vía transcervical a la cavidad endometrial. Estos ovocitos fecundados en laboratorio iniciarán por tanto la división celular, exactamente igual que lo harían en el interior del tracto genital femenino, transformándose en embriones, los cuales serán finalmente transferidos al útero materno. La fertilización puede ser confirmada mediante la visualización de dos pronúcleos y dos cuerpos polares al día siguiente de la fertilización. Dos días después de esta, el embrión posee de dos a cuatro células (figura 1) alcanzando las ocho el tercer día.
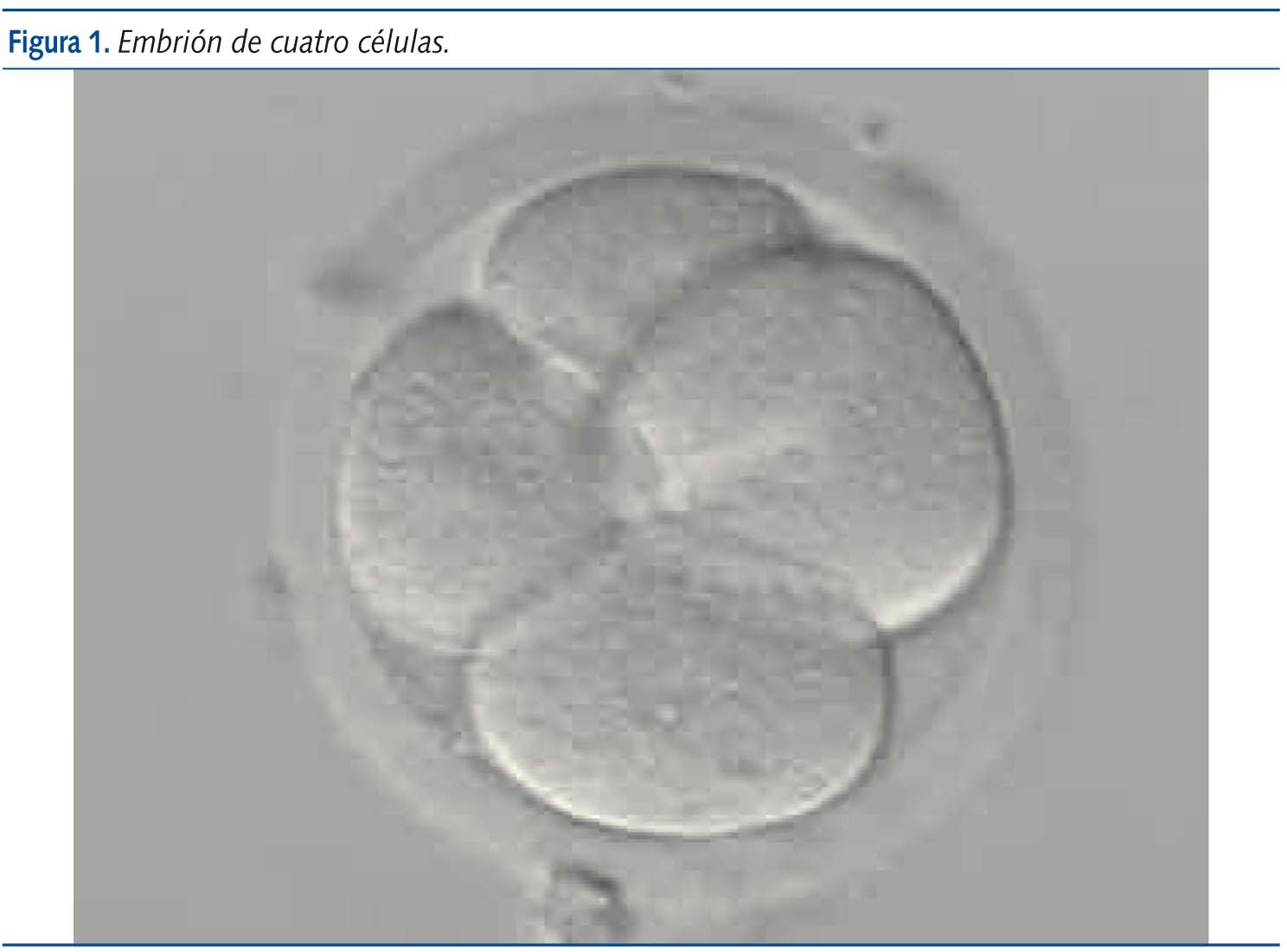
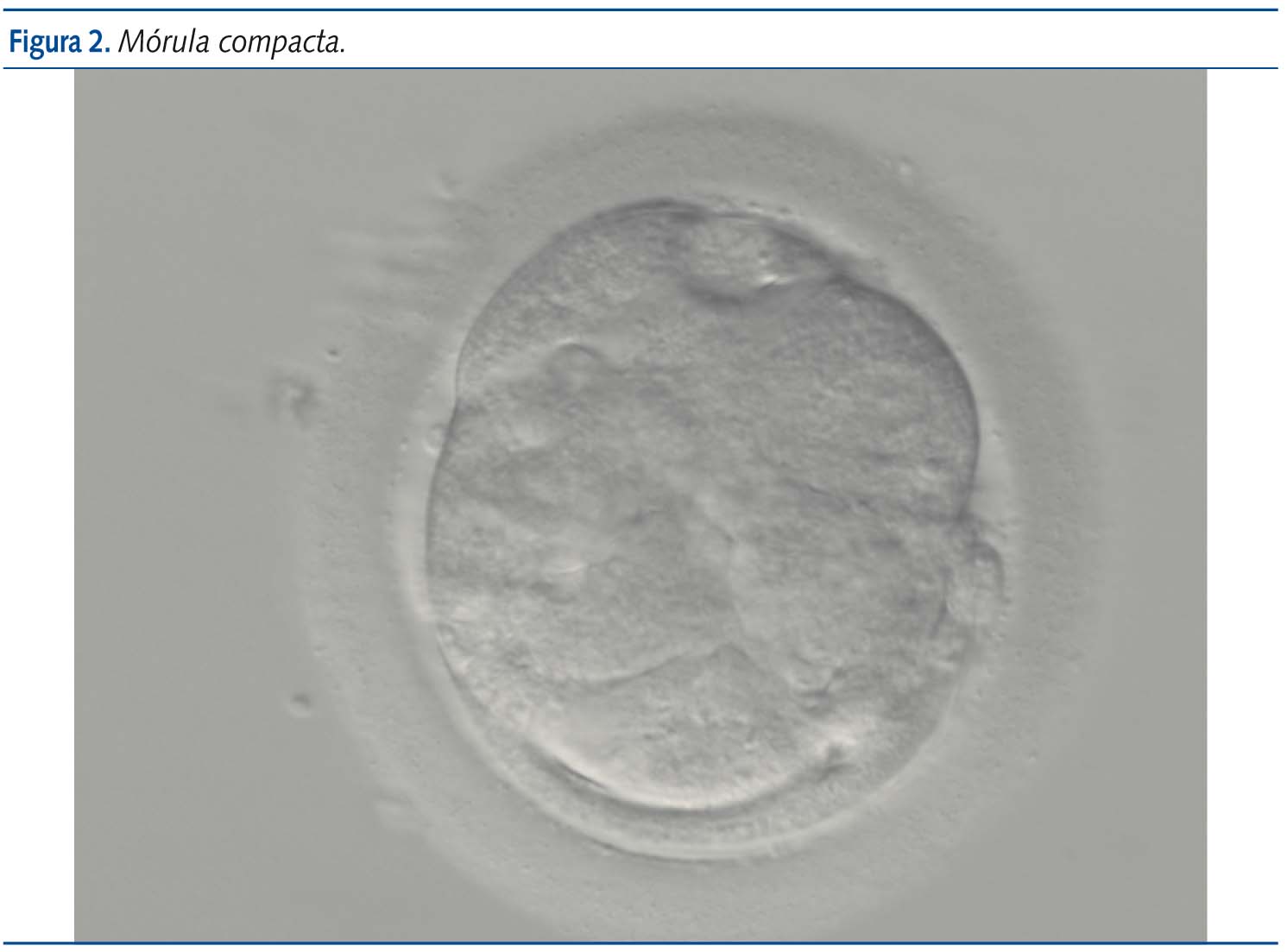
En el estadio de 16 células el embrión es una masa sólida llamada mórula (figura 2) en la que no se pueden distinguir las células individualmente. Al quinto día se alcaza el estadio de blastocisto (figura 3), que contiene una cavidad rellena de líquido, una masa de células internas que darán origen al embrión (embrioblasto) y una capa fina de células externas, denominadas trofoblasto, que dará lugar posteriormente a la placenta. La transferencia embrionaria se realiza típicamente en el estadio de ocho células o de blastocisto, también mediante la inserción de un catéter a través del cérvix y hasta el útero4,6.
En un principio, la FIV también surgió como tratamiento de la infertilidad debida a patología tubárica bilateral, es decir, cuando la mujer tiene las dos trompas de Falopio obstruidas y por tanto es imposible que de forma natural se pongan en contacto óvulos y espermatozoides. Hoy en día tiene otras muchas indicaciones, entre las que se incluyen la esterilidad por factor masculino (la FIV permite concentrar los espermatozoides, seleccionarlos y ponerlos en contacto directo con el óvulo), la disfunción ovárica (se seleccionan en el laboratorio los embriones con mayor potencial de desarrollo), la endometriosis, la presencia de anticuerpos anti-espermatozoides en la mujer o en el hombre, o los fallos de la inseminación artificial (cuando no se consigue gestación tras 4-6 ciclos).
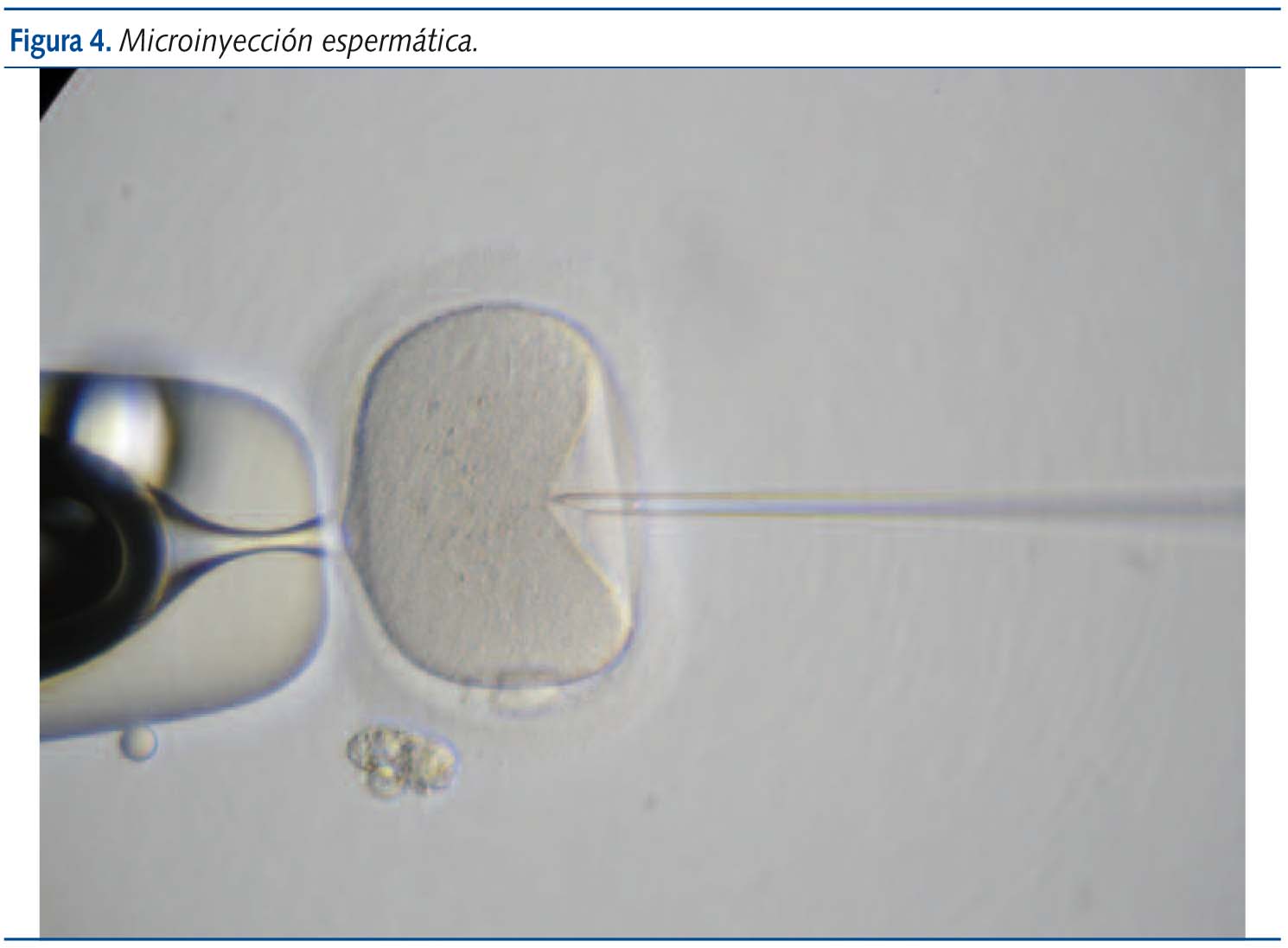
Microinyección espermática
La microinyección espermática intracitoplasmática (intracitoplasmic sperm injection-ICSI) es una de las técnicas más novedosas y que mayor repercusión han tenido en el tratamiento de la infertilidad. Aunque se venía investigando desde la aparición de las primeras técnicas de reproducción asistida, el primer embarazo conseguido mediante esta técnica data de 1992. Hoy en día ya se cuentan por miles los niños y niñas nacidas gracias al ICSI. Su incorporación al laboratorio de FIV como método de rutina está avalada tanto por los resultados obtenidos como por las nuevas perspectivas de tratamiento que ofrece a parejas con infertilidad debida a factor masculino severo y que veían anteriormente limitadas sus posibilidades de procreación mediante la fecundación in vitro convencional1,9.
Básicamente, la técnica consiste en la inyección de un solo espermatozoide dentro del ovocito (figura 4). El razonamiento para llevar a cabo esta técnica es que sabemos que de forma natural, para que un óvulo pueda ser fecundado por un espermatozoide, una gran cantidad de éstos deben adherirse a la membrana que rodea al óvulo (zona pelúcida). Al unirse a ella, por medio de unos receptores específicos situados tanto en la zona pelúcida como en la cabeza del espermatozoide, este libera unas sustancias que alteran la zona permitiendo que uno de ellos penetre hasta el interior del ovocito. Si no se adhiere suficiente cantidad de espermatozoides, ninguno de ellos podrá fecundar. Esta falta de adhesión podrá deberse, por tanto, a la presencia de un número muy escaso de espermatozoides (insuficiente para alterar la zona), a la ausencia de receptores (hay numerosos espermatozoides pero no se adhieren a la zona) o sencillamente a una incapacidad de fecundar por parte de los espermatozoides (porque no pueden atravesar las células de la granulosa que rodean al óvulo y alcanzar la zona pelúcida o porque una vez alcanzada esta, son incapaces de atravesarla).
Aunque el desarrollo de esta técnica estuvo encaminado a poder tratar específicamente la infertilidad masculina, actualmente también puede aplicarse en todos aquellos casos en los que pueda haber un fallo de fecundación tras realizar una FIV. Las actuales indicaciones para la ICSI incluyen por tanto a aquellos pacientes que, debido a una alteración en su función testicular o a la obstrucción de los conductos excretores, cuentan con un bajo número, morfología anormal y/o falta de movilidad en los espermatozoides del eyaculado. Incluso en el caso de que el paciente haya sido diagnosticado de azoospermia (ausencia absoluta de espermatozoides en el eyaculado) o de que todos los espermatozoides que se encuentren en el semen estén inmóviles, es posible utilizar espermatozoides obtenidos directamente del testículo o del epidídimo para realizar la microinyección. En ocasiones, cuando no se recuperan espermatozoides maduros del eyaculado o de la biopsia testicular, se ha recurrido a microinyectar espermátides (formas inmaduras) y se han publicado embarazos tras su utilización, aunque con baja tasa de éxito9.
Otras indicaciones serían todos aquellos casos en los que por la presencia o ausencia de determinados factores (conocidos o no) que afectan directamente al proceso de fecundación (como una alta tasa de anticuerpos anti-espermatozoides o la ausencia de receptores en la zona pelúcida o en los mismos espermatozoides que permitan la adhesión de estos al ovocito), no es posible lograr embriones en un número adecuado mediante técnicas de FIV convencional.
Donación de óvulos. Donación de semen
Todas las técnicas anteriormente descritas pueden llevarse a cabo con espermatozoides y óvulos que no pertenezcan a la pareja con problemas de fertilidad. La inseminación artificial con semen de donante es un tratamiento de reproducción asistida que se lleva a cabo cuando no se pueden utilizar espermatozoides de la pareja para conseguir el embarazo. En la actualidad, los avances en el diagnóstico del factor masculino, en su tratamiento y sobre todo en las técnicas de fecundación asistida, como la microinyección espermática intracitoplasmática hacen que cada vez se tenga que recurrir con menos frecuencia a la utilización de semen de donante. Sin embargo, hay ocasiones en las que es imposible conseguir espermatozoides, ni siquiera tras un tratamiento médico del varón o, como se ha comentado anteriormente, incluso tras realizar una biopsia testicular para obtener espermatozoides. Son casos en los que, de nacimiento, no se generan las células que dan lugar a los espermatozoides o bien estas funcionan incorrectamente y no llegan a producir espermatozoides (bloqueo madurativo de la espermatogénesis). En otras ocasiones sí hay algún espermatozoide, pero o bien están todos muertos (necrozoospermia) o ninguno de ellos presenta una correcta morfología (teratozoospermia). Existen, por último, pacientes en los que sí hay espermatozoides, e incluso con movilidad y en mayor o menor cantidad, pero todos ellos, o en gran mayoría, podrían transmitir algún tipo de enfermedad, malformación o alteración genética al feto en el caso de que se produjera un embarazo (se incluyen en este apartado las enfermedades de transmisión sexual, y la incompatibilidad Rh con isoinmunización previa). Ante todas estas circunstancias, así como en aquellas en las que el número de espermatozoides móviles sea muy bajo y no se utilicen técnicas de ICSI, o en algunos casos en los que a consecuencia de alteraciones en el semen la calidad embrionaria sea muy baja, es posible recurrir a espermatozoides de un donante para conseguir el embarazo. Además, nuestra legislación permite la utilización de semen de donante en mujeres sin pareja masculina que solicitan el uso de estos tratamientos7.
La donación de ovocitos se ha definido clásicamente como la técnica de reproducción asistida en la cual el gameto femenino es aportado por una mujer distinta a la que recibirá este o el embrión resultante. Los excelentes resultados de esta técnica han llevado a una generalización de sus indicaciones. En general, la FIV con donación de óvulos se realiza en aquellos casos en los que sea imposible la obtención de ovocitos en la paciente, como en el caso de una menopausia o de fallo ovárico precoz, cuando estos ovocitos puedan transmitir algún tipo de enfermedad, o como consecuencia de una calidad embrionaria baja tras repetidos intentos de fecundación con los propios óvulos de la paciente sin conseguir gestación. También se utilizan en caso de pérdidas gestacionales repetidas e inexplicables, o ante una mala calidad ovocitaria10.
Diagnóstico genético preimplantacional
La capacidad de biopsiar embriones y los avances en la genética molecular han permitido realizar análisis preimplantacionales de los embriones creados a través de la fertilización in vitro en un proceso denominado diagnóstico genético preimplantacional (DGP). Esta técnica permite reducir el riesgo de concepción de un niño con una anomalía genética, siempre y cuando esta anomalía haya sido identificada y pueda ser analizada en una única célula. Una de las ventajas principales de esta técnica, sobre el diagnóstico prenatal convencional, es que permite detectar tempranamente los embriones afectados antes de su transferencia, reduciendo el riesgo de tener que terminar la gestación posteriormente1,11,12. Aunque existen varios métodos de biopsiar los embriones para realizar el DGP, el más comúnmente usado consiste en analizar genéticamente una o dos células de un embrión en estadio de ocho células. Este análisis genético se realiza usando tanto hibridación fluorescente in situ (FISH) como la reacción en cadena de la polimerasa (PCR).
Las técnicas de DGP están limitadas por varios factores que incluyen el corto espacio de tiempo disponible para la realización de los análisis antes de que los embriones puedan ser transferidos, el limitado material genético disponible para su amplificación, y los resultados falsos positivos y falsos negativos debido a mosaicismo genético. Para evitar el riesgo de errores diagnósticos, se recomienda la realización de una biopsia de vellosidades coriónicas o una amniocentesis durante la gestación.
Las primeras técnicas de DGP se usaron para la selección sexual y para prevenir la transmisión de enfermedades ligadas al cromosoma X en embriones masculinos. Hoy en día se realiza el DGP para múltiples anomalías genéticas, que incluyen enfermedades hereditarias transmitidas por un gen único (recesivas como fibrosis quística, beta-talasemia, anemia de células falciformes o dominantes como hemofilia o distrofia miotónica), anomalías cromosómicas estructurales (translocaciones, inversiones o deleciones), detección de susceptibilidad de enfermedades genéticas de presentación tardía (Huntington, Alzheimer) y tipificación de HLA para establecer la potencialidad de donación de un embrión en casos de anemia de Fanconi o leucemia13-19.
Impacto de las técnicas de reproducción asistida en la salud infantil
Desde sus inicios, ha existido una gran preocupación sobre la posibilidad de que las TRA pudieran tener efectos adversos tanto sobre el desarrollo embriofetal como a largo plazo. De hecho, aunque la utilización clínica de las TRA no sobrepase las tres décadas, la literatura científica existente sobre este tema es amplísima. Además, al revisar esta literatura resulta fácil detectar diferentes posicionamientos frente a los efectos de la TRA, no solo en los distintos grupos, sino también las distintas áreas profesionales desde las que se estudian estos procesos (investigación básica, obstetricia, pediatría, reproducción…), lo que en ocasiones lleva a confusión sobre la interpretación de los resultados de diferentes estudios. Estos trabajos, en general, son de corta duración, poco controlados y con tasas de seguimiento pobres. Faltan estudios prospectivos de gran tamaño y amplio alcance con casos-controles adecuados que puedan responder a muchas de las dudas que nos planteamos en el momento actual.
Todas las gestaciones producidas por TRA tienen que considerarse gestaciones de alto riesgo debido a varias razones. En primer lugar, la enfermedad inherente a las parejas que se han realizado TRA, que puede llevar a complicaciones obstétricas, como hipertensión arterial y diabetes gestacional, y que están relacionadas más con la infertilidad que con la técnica utilizada. Por otro lado, las mujeres que se realizan TRA tienen probabilidad de tener un parto prematuro y un niño de bajo peso al nacer. Varias publicaciones han demostrado que la infertilidad por sí misma también está asociada a una disminución de peso de los recién nacidos, incluso cuando los embarazos son espontáneos. Además, los problemas médicos relacionados con las gestaciones por TRA pueden deberse a que estas técnicas y el uso de fármacos inductores de la ovulación condicionan embarazos múltiples que se asocian a más complicaciones obstétricas y neonatales. Mientras que algunos estudios han detectado un mayor número de malformaciones congénitas presentes al nacimiento tras TRA, otros estudios no hallan diferencias. También están por resolver las incertidumbres generadas en cuanto al pronóstico neurológico y las posibles alteraciones en el neurodesarrollo a largo plazo de los niños nacidos tras estos tratamientos.
Gestaciones múltiples
Las gestaciones múltiples espontáneas ocurren en 1 de cada 90 embarazos. La era de las TRA ha incrementado el número de partos múltiples y, así, la incidencia de gemelos es actualmente de uno por cada 45 partos en los Estados Unidos. En este país, donde las TRA son responsables de aproximadamente un 1% de todos los nacimientos, se estima que son causa de un 18% de los nacimientos múltiples4,20. Aunque la mayoría de estas gestaciones son gemelares y dicigóticas, estos tratamientos aumentan el riesgo de partos triples o cuádruples y de gestaciones monocigotas.
Las principales complicaciones fetales y neonatales de estos embarazos múltiples son bien conocidas: un mayor índice de mortalidad perinatal, parto pretérmino, cesárea, bajo peso al nacimiento, preeclampsia, diabetes gestacional, desprendimiento de placenta, placenta previa y hemorragia posparto. En los embarazos multifetales, la duración media del embarazo es menor y se acorta a medida que aumenta el número de fetos (36 semanas en gemelos, 32 en trillizos y 31 en cuatrillizos). Alrededor de un 10% de los trillizos nace antes de las 28 semanas de embarazo. Por otro lado, la probabilidad de un peso al nacer inferior a 1500 g es 8 y 33 veces mayor en embarazos gemelares y de trillizos o embarazos múltiples de mayor orden21. Las causas de estos nacimientos prematuros son múltiples (rotura prematura de membrana o inducción del parto debido a indicaciones maternas y fetales, como la preeclampsia, el sufrimiento fetal, la restricción del crecimiento o la muerte de un feto). La restricción del crecimiento y la discordancia del peso ocurren fundamentalmente a partir de las 30 semanas de gestación, después de lo cual el crecimiento de los embarazos múltiples disminuye gradualmente comparado con el de los monofetales. Probablemente, el mecanismo es la mayor ocupación uterina y la limitación de la perfusión placentaria21.
Por otro lado, las malformaciones congénitas ocurren en alrededor del 6% de los embarazos gemelares, riesgo que es 2,5 veces mayor en gestaciones monocigóticas que en dicigóticas. Estas anomalías fetales pueden ser anomalías cromosómicas, defectos de gen único o defectos estructurales precoces. También están aumentadas las anomalías vasculares placentarias (síndrome de transfusión feto-fetal, inserción velamentosa de cordón y vasa previa, interrupción del flujo sanguíneo del cordón…) que pueden afectar gravemente a uno o ambos gemelos21.
Cada vez existe una mayor concienciación sobre los riesgos de las gestaciones múltiples, y actualmente ha disminuido la tasa de embarazos múltiples de alto grado por la mejora en las técnicas y el control de la estimulación ovárica, y la limitación en el número de embriones trasferidos, evitando transferencias múltiples en mujeres con buen pronóstico (edad menor de 35 años, buena calidad embrionaria, primer ciclo de FIV)22. Incluso, en los últimos años se está abogando por la transferencia de un solo embrión, de gran calidad, en parejas de buen pronóstico. Distintos estudios han demostrado que con este procedimiento la tasa de gestaciones es similar a cuando se transfieren dos embriones, reduciendo drásticamente el número de gestaciones múltiples. Además, mediante la transferencia de un solo embrión también se evitarían los riesgos derivados de los fenómenos de embriorreducción o evanescencia embrionaria de las gestaciones múltiples, y que suponen un 10% de las gestaciones únicas obtenidas por TRA23,24.
Parto pretérmino. Retraso de crecimiento intrauterino
Las TRA aumentan la tasa de nacimientos pretérmino y de bajo peso, aun en caso de gestaciones únicas. En Estados Unidos, este aumento se ha estimado en 2,6 veces superior que en las concepciones naturales, con las importantes implicaciones médicas, sociales y de gasto sanitario que este problema conlleva1-3. Diversos estudios y metaanálisis han mostrado que el riesgo de prematuridad se duplica cuando se utilizan estos tratamientos, y también se incrementa el riesgo de muy bajo peso y bajo peso para la edad gestacional25-31. La etiología de este fenómeno es incierta, aunque se ha tratado de explicar basándose en la edad materna, la posible influencia de las medicaciones aplicadas en estas técnicas, la diferencia en el manejo obstétrico en este grupo de madres, o incluso una alteración en los niveles de proteínas ováricas o uterinas circulantes en las gestaciones producidas tras TRA.
Ingreso en Unidades de Cuidados Intensivos Pediátricos. Mortalidad perinatal
Los resultados de los distintos estudios son coincidentes con lo hallado para el retraso de crecimiento intrauterino y la prematuridad. Así, se ha observado un aumento de ingreso en Unidades de Cuidados Intensivos Pediátricos (UCIN) de casi un 30% en las gestaciones únicas obtenidas por TRA24. Sin embargo, existe una gran discrepancia de resultados en las gestaciones gemelares. Algunos autores no encuentran un incremento de riesgo respecto a las gestaciones gemelares espontáneas y otros observan hasta el doble de riesgo, debido al aumento de las tasas de prematuridad en las mismas31. Con respecto a la mortalidad perinatal, algunos estudios sugieren que puede existir hasta un 70% de incremento de riesgo de mortalidad perinatal en las gestaciones únicas obtenidas por FIV24. Los resultados de mortalidad en embarazos gemelares tras TRA son similares cuando se comparan con gestaciones gemelares espontáneas31.
Malformaciones congénitas. Cromosomopatías. Enfermedades genéticas
Aunque los estudios iniciales no mostraron un incremento en el riesgo de malformaciones congénitas en los niños nacidos tras FIV, otros trabajos más recientes ponen en duda esta afirmación32-34. Tanto la edad avanzada de algún miembro de la pareja como la causa subyacente de la infertilidad juegan un papel importante en el riesgo de malformaciones mayores. Sin embargo, la mayoría de los estudios publicados sobre el tema son observacionales, y con una muestra de tamaño insuficiente que no permite evaluar con fiabilidad posibles diferencias en la aparición de anomalías congénitas de muy baja prevalencia en la población general35.
Recientemente, se ha estimado que haría falta un estudio colaborativo internacional con un tamaño muestral de embarazos post-TRA entre 10 000 y 84 000 o más para poder responder con certeza absoluta a esta cuestión36. Por otro lado, es difícil la comparación entre diversos estudios, en tanto que todos los centros no realizan el mismo protocolo de despistaje de anomalías congénitas ni tienen el mismo registro de malformaciones congénitas. Es más, tampoco hay acuerdo unánime para su clasificación. También tenemos que estar seguros de que los embarazos post-TRA no reciben una mayor atención y vigilancia pre y postnatal en comparación con los embarazos naturales. Si así fuera, estaríamos introduciendo un sesgo importante que dificultaría enormemente la correcta interpretación de los resultados, al sobrestimar el riesgo en el grupo de las TRA. Con todas estas premisas, existen distintos estudios que han observado un modesto aumento de malformaciones congénitas en los niños nacidos tras TRA. Así, un trabajo australiano que analizó 1138 recién nacidos por FIV-ICSI frente a 4000 concepciones naturales, demostró un aumento de la incidencia de malformaciones congénitas diagnosticadas antes del primer año de vida en recién nacidos productos de FIV o ICSI (8,6% y 9% respectivamente) frente a un 4,2% en niños nacidos tras gestaciones espontáneas32. Este incremento ha sido confirmado en un reciente metaanálisis de 25 estudios que ha sugerido que hay de un 30% a un 40% de incremento en el riesgo de defectos congénitos asociados con estas técnicas33. Por otro lado, un extenso trabajo sueco que comparó las malformaciones congénitas de 9175 niños nacidos tras FIV-ICSI desde 1982 a 1997 frente a un grupo control de 1 690 577 niños concebidos espontáneamente en el mismo periodo mostró que la FIV estaba relacionada con casi tres veces más defectos en el tubo neural, atresia esofágica, de intestino delgado o anal, onfalocele o hipospadias34.
Desde el punto de vista genético, hay evidencia de un incremento de anomalías cromosómicas en los embarazos que ocurren tras ICSI al compararlo con la población general neonatal37,38. Se ha descrito un incremento en la aneuploidía del cromosoma sexual de novo y anomalías estructurales autosómicas. Estos hallazgos probablemente reflejan la mayor incidencia de alteraciones cromosómicas en los padres con ICSI. Se estima que un 3%-15% de los varones con muy bajo recuento espermático o azoospérmicos tienen microdeleciones en el cromosoma Y, y pueden transmitir estas anomalías39. Por otro lado, los síndromes con alteración del imprinting genómico (Wiedemann-Beckwith, Angelman, Silver-Rusell, Albrigth, Prader Willi), que son muy infrecuentes en la población general, tienen una mayor prevalencia en los recién nacidos tras FIV40. El imprinting genómico hace referencia a la expresión diferente de un gen según se herede del padre o de la madre. Estos genes presentan una diferencia funcional tras sufrir un “marcaje” diferente durante la gametogénesis. Este “marcaje” condicionaría que los genes implicados no llegaran a expresarse y permanecieran inactivos41. El aumento de frecuencia de estas raras enfermedades se relaciona por tanto con modificaciones epigenéticas, tanto en la metilación del ADN como en el imprinting, procesos que tienen lugar en el periodo de preimplantación, cuando se está realizando la FIV o la ICSI. Por ello, además de un mayor riesgo de padecer estos síndromes, cabría también la posibilidad de que se observara un aumento en el desarrollo posterior de cánceres por inactivación de genes supresores del crecimiento tumoral. Aunque esta posibilidad es muy plausible, se debe estudiar en profundidad antes de establecer una conclusión final.
Pronóstico neurológico
En los últimos años, otros se han generado incertidumbres acerca de las posibles implicaciones que las TRA podrían tener en el desarrollo neurológico y psicosocial de los niños nacidos tras estos tratamientos. El término desarrollo neuropsicológico comprende un amplio campo dentro del crecimiento y seguimiento del niño y abarca no solo las secuelas neurológicas, el riesgo de parálisis cerebral, y la necesidad de ingreso y tratamiento por patología neurológica, sino también el desarrollo psicomotor, la adquisición de los hitos del desarrollo y la valoración cognitiva, del lenguaje y de la comprensión, así como el comportamiento del niño en el entorno social que le rodea y la actitud de los padres hacia la propia paternidad42. En general, en los distintos estudios realizados, los niños producto de gestación única no presentan diferencias significativas respecto de los espontáneos en los estudios de evaluación del neurodesarrollo realizados entre los dos y los ocho años de edad43-47. Casi todos los trabajos coinciden en que los niños procedentes de gestaciones únicas nacidos a término no presentan diferencias con aquellos a término concebidos de forma natural. Sin embargo, otros estudios de investigación amplios, basados en registros de cohortes, han observado un ligero incremento de parálisis cerebral, posiblemente debido a la inclusión de recién nacidos de menos de 32 semanas de edad postconcepcional35. Por otro lado, se ha estudiado el efecto que tendría la muerte intrauterina de uno de los fetos (en un embarazo inicialmente gemelar) sobre el gemelo superviviente. Estos niños tienen un alto riesgo de secuelas neurológicas, comparados con la población general de gemelos. La causa no está del todo clara, pero se relaciona posiblemente con la prematuridad y la mayor incidencia de monocoronicidad. Este hallazgo podría ser un factor que explicara el incremento de riesgo de parálisis cerebral en los partos únicos y se ha señalado la posibilidad de muerte intrauterina no detectada en transferencias embrionarias dobles, que afectaría al gemelo superviviente48,49.
En el campo del desarrollo socioemocional se valora no solo la evolución en el desarrollo social y emocional del niño nacido tras TRA sino también la relación de este con los padres y la propia actitud de los progenitores ante la paternidad. La posibilidad de impacto psicológico negativo en los niños concebidos tras TRA es una duda que se ha planteado siempre que se ha revisado este tema. El efecto psicológico y la situación de estrés e incertidumbre que conlleva todo el proceso de reproducción asistida sobre los progenitores pueden repercutir sobre la actitud y expectativas de los padres ante el hijo y la paternidad. El niño puede ser, en ocasiones, un recordatorio constante de la situación frustrante de infertilidad vivida por la pareja o, al contrario, ser valorado como algo muy preciado y estar sobreprotegido por sus padres y el entorno que les rodea. En los estudios realizados para evaluar este tema no se ha evidenciado un impacto psicológico negativo en los niños o padres que han sido sometidos a estas técnicas. Al contrario, parece existir una actitud más positiva hacia la paternidad y menos sentimientos hostiles hacia los niños en las madres sometidas a ICSI seguidas durante un periodo de cinco años, sin evidenciarse efectos psicológicos negativos asociados42,50.
Conclusiones
Las técnicas de reproducción asistida son tratamientos cada vez más utilizados y es imperativo continuar perfeccionándolas, no solo para conseguir un incremento en el éxito de las mismas sino también para, al mismo tiempo, reducir el riesgo de complicaciones asociadas a su uso y que tienen influencia en la salud pediátrica (gestaciones múltiples, parto pretérmino). Hay que ser cuidadosos a la hora de informar a los futuros padres acerca del discreto aumento de la tasa de incidencia de malformaciones congénitas, genéticas o alteración en el desarrollo psicomotor, teniendo en cuenta la variabilidad de datos disponibles, la infrecuencia de las alteraciones, y el esfuerzo médico, social y emocional que estas terapias requieren. Se deben diseñar estudios multicéntricos, controlados y de gran tamaño muestral que analicen fielmente el impacto de estas técnicas en estos y otros aspectos de la salud infantil.
Bibliografía
- Pauli SA, Berga SL, Weirong Shang DR. Current Status of the Approach to Assisted Reproduction. Pediatr Clin N Am. 2009;56:467-88. Acceso 18 Septiembre 2009. Disponible en http://www.cdc.gov/art/ART2006/index.htm.
- Cabañas F. López-Azorín M, Pellicer A. Impacto de las técnicas de reproducción asistida en la salud del recién nacido. An Pediatr (Barc). 2009;70:319-22.
- Bruna I, Coroleu B, Bajo JM. Estudio protocolizado de la pareja estéril. En: Bajo Arenas JM, Corolleu Lletget B, eds. Fundamentos de reproducción. 1ª ed. Madrid: SEGO; 2009. p. 48-56.
- Ballesteros A, Paredes O, Landeras J, Nicolás M, Fernández L, Sellés E, y cols. Estudio de la pareja estéril. En: Remohí J, Pellicer A, Simón C, Navarro J, eds. Reproducción humana. 2ª ed, Madrid: Mc Graw-Hill-Interamericana; 2002. p. 3-14.
- Hrometz SL, Gates VA. Review of available infertility treatments. Drugs Today (Barc). 2009;45:275-91.
- Requena A, Martínez Salazar J, Párraga M. Inseminación artificial. En: Remohí J, Pellicer A, Simón C, Navarro J, eds. Reproducción humana. 2ª ed. Madrid: McGraw-Hill Interamericana; 2002. p. 263-72.
- Ruiz A, Cobo A, Romero JL. Actual papel de la Fecundación in Vitro. En: Remohí J, Pellicer A, Simón C, Navarro J, eds. Reproducción humana. 2ª ed, Madrid: McGraw-Hill Interamericana; 2002. p. 437-42.
- Romero JL, Albert C, Zulategui J. La microinyección intracitoplasmática de espermatozoides como técnica de reproducción asistida. En: Remohí J, Pellicer A, Simón C, Navarro J, eds. Reproducción humana. 2ª ed. Madrid: McGraw-Hill Interamericana; 2002. p. 443-53.
- Bosch E, Bellver J, Escudero E. Donación de ovocitos. En: Remohí J, Pellicer A, Simón C, Navarro J, eds. Reproducción humana. 2ª ed. Madrid: McGraw-Hill Interamericana; 2002. p. 489-98.
- Preimplantation genetic testing: a Practice Committee opinion. Fertil Steril. 2008;90(Suppl 5):S136-43.
- Mastenbroek S, Twisk M, van Echten-Arends J. In vitro fertilization with preimplantation genetic screening. N Engl J Med. 2007;357: 9-17.
- Handyside AH, Lesko JG, Tarin JJ. Birth of a normal girl after in vitro fertilization and preimplantation diagnostic testing for cystic fibrosis. N Engl J Med. 1992;327:905-9.
- Ray PF, Kaeda JS, Bingham J. Preimplantation genetic diagnosis of betathalassaemia major. Lancet. 1996;347:1696.
- Xu K, Shi ZM, Veeck LL. First unaffected pregnancy using preimplantation genetic diagnosis for sickle cell anemia. JAMA. 1999;281:1701-6.
- Sermon K, Lissens W, Joris H. Clinical application of preimplantation diagnosis for myotonic dystrophy. Prenat Diagn. 1997;17:925-32.
- Verlinsky Y, Rechitsky S, Schoolcraft W. Preimplantation diagnosis for Fanconi anemia combined with HLA matching. JAMA. 2001;285:3130-3.
- Verlinsky Y, Rechitsky S, Verlinsky O. Preimplantation diagnosis for p53 tumour suppressor gene mutations. Reprod Biomed Online. 2001;2:102-5.
- Verlinsky Y, Rechitsky S, Verlinsky O. Preimplantation diagnosis for early onset Alzheimer disease caused by V717L mutation. JAMA. 2002;287:1018-21.
- Schieve LA, Peterson HB, Meikle SF. Live-birth rates and multiple-birth risk using in vitro fertilization. JAMA. 1999;282:1832-8.
- Danhaive O. Partos Múltiples. En: Cloherty JP, Eichenwald EC, Stark AR, eds. Manual de Cuidados Neonatales. 5ª ed. Barcelona: Masson; 2005. p. 103-16.
- Guidelines on number of embryos transferred. Fertil Steril. 2006;86(Suppl 5):S51-2.
- Thurin A, Hausken J, Hillensjo T. Elective single-embryo transfer versus double embryo transfer in in vitro fertilization. N Engl J Med. 2004;351:2392-402.
- Medina Malo L. Técnicas de reproducción asistida y gestaciones únicas y múltiples: comparación de resultados perinatales. CMR. 2010;16:17-26.
- Helmerhorst FM, Perquin DAM, Donker D, Keirse MJNC. Perinatal outcome of singletons and twins after assisted conception: a systematic review of controlled studies. BMJ. 2004;328:261.
- Jackson RA, Gibson KA, Wu YW, Croughan MS. Perinatal outcomes in singletons following in vitro fertilization: a metaanalysis. Obstet Gynecol. 2004;103:551-63.
- McGovern PG, Llorens AJ, Skurnick JH, Weiss G, Goldsmith LT. Increased risk of preterm birth in singleton pregnancies resulting from in vitro fertilization-embryo transfer or gamete intrafallopian transfer: a meta-analysis. Fertil Steril. 2004;82:1514-20.
- Schieve LA, Meikle SF, Ferre C. Low and very low birth weight in infants conceived with use of assisted reproductive technology. N Engl J Med. 2002;346:731-7.
- Schieve LA, Ferre C, Peterson HB. Perinatal outcome among singleton infants conceived through assisted reproductive technology in the United States. Obstet Gynecol. 2004;103:1144-53.
- Van Steirteghem A. Outcome of assisted reproductive technology. N Engl J Med. 1998;338:194-5.
- McDonald SD, Murphy K, Beyen J, Ohlsson A. Perinatal outcomes of in vitro fertilization twins: a systematic review and meta-analysis. Am J Obstet Gynecol. 2005;193:141-52.
- Hansen M, Bower C, Milne E. Assisted reproductive technologies and the risk of birth defects–a systematic review. Hum Reprod. 2005;20:328-38.
- Hansen M, Kurinczuk JJ, Bower C. The risk of major birth defects after intracytoplasmic sperm injection and in vitro fertilization. N Engl J Med. 2002;346:725-30.
- Ericson A, Kallen B. Congenital malformations in infants born after IVF: a population-based study. Hum Reprod. 2001;16:504-9.
- Serra V, Tortajada M, Lara C. Técncas de reproducción asistida y anomalías congénitas estructurales. CMR. 2010;16:41-8.
- Bukulmez O. Does assisted reproductive technology cause birth defects? Curr Opin Obstet Gynecol. 2009;21:260-4.
- In’t Veld PA, Van Opstal D, Van den Berg C. Increased incidence of cytogenetic abnormalities in chorionic villus samples from pregnancies established by in vitro fertilization an embryo transfer (IVF-ET). Prenat Diagn. 1995;15:975-80.
- Bonduelle M, Van Assche E, Joris H. Prenatal testing in ICSI pregnancies: incidence of chromosomal anomalies in 1586 karyotipes and relation to sperm parameters. Hum Reprod. 2002;17:2600-14.
- Martin RH, Rademaker AW, Greene C. Comparison of the frequency os sperm chromosomal abnormalities in men with mild, moderate, and severe oligozoospermia. Biol Reprod. 2003;69:535-9.
- Cox GF, Burger J, Lip V. Intracytoplasmic sperm injection may increase the risk of imprinting defects. Am J Hum Genet. 2002;71:162-4.
- Campos-Castelló J, Bueno-Lozano G, de Santos-Moreno MT. El fenómeno del ‘imprinting’ genómico y sus implicaciones en clínica neuropediátrica. Rev Neurol. 1999;28:69-73.
- García-Zarza Martínez E. Desarrollo neuropsicológico y social en niños concebidos mediante reproducción asistida. CMR. 2010;16:71-8.
- Sutcliffe AG, Taylor B, Saunders K, Thornton S, Lieberman BA, Grudzinskas JG. Outcome in the second year of life after in vitro fertilization by intracytoplasmatic sperm injection: a UK case-control study. Lancet. 2001;357:2080-4.
- Place I, Englert Y. A prospective longitudinal study of the physical psicomotor and intellectual development of singleton children up to 5 year who were conceived by intracytoplasmatic sperm injection compared with children conceived spontaneously and in vitro fertilization. Fertil Steril. 2003;80:1388-97.
- Ponjaert-Kristoffersen I, Bonduelle M, Barnes J. International collaborative study of intra-cytopasmatic sperm injection-conceived, in vitro fertilization-conceived, and naturally conceived 5-year-old child outcomes: cognitive and motor assessments. Pediatrics. 2005;115:e283-9.
- Stromberg B, Dahlquist G, Ericson A, Finnstrom O, Koster M, Stjernqvist K. Neurological sequelae in chidren born after invitro fertilization: a population-based study. Lancet. 2002;359:461-5.
- Glinianaia SV, Pharoah PO, Wright C, Rankin JM, Northern Region Perinatal Mortality Survey Steering Group. Fetal or infant death in twin pregnancy: neurodevelopmental consequence for the survivor. Arch Dis Child Fetal Neonatal Ed. 2002;355:1597-602.
- Middelburg KJ, Heineman MJ, Bos AF, Hadders-Algra M. Neuromotor, cognitive, language and behavioural outcome in children born following IVF or ICSI–a systematic review. Hum Reprod Up, 2008;14:219-31.
- Pharoah PO, Adi Y. Consequences of in-utero death in a twin pregnancy. Lancet. 2000;355:1597-602.
- Barnes J, Sutcliffe AG, Kristoffersen I. The influence of assisted reproduction on family functioning and children´s socio emotional development: results from a European study. Hum Reprod. 2004;19:1480-7.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
Comentarios
Este artículo aún no tiene comentarios.





