Vol. 12 - Num. 48
Originales
Sustitución segura de la lactancia materna para prevenir la transmisión vertical del VIH en la Provincia Central de Kenia
Victorio Torres Feceda, M Wachirab, R Bedella, J Mwangib, D Dalmauc, L Kocholab, S Morenoa, G Mutheeb, G Riarab, R Ngarurob
aAsociación Vihda.
bMinisterio de Servicios Médicos. Kenia.
cSociedad Española Interdisciplinaria de SIDA (SEISIDA).
Correspondencia: V Torres. Correo electrónico: victorio.torres@gmx.net
Cómo citar este artículo: Torres Feced V, Wachira M, Bedell R, Mwangi J, Dalmau D, Kochola L, et al. Sustitución segura de la lactancia materna para prevenir la transmisión vertical del VIH en la Provincia Central de Kenia. Rev Pediatr Aten Primaria. 2010;12:595-614.
Publicado en Internet: 14-01-2011 - Número de visitas: 29846
Resumen
Introducción: la lactancia materna es responsable de hasta un 40% de los contagios perinatales del virus de la inmunodeficiencia humana (VIH) en el África subsahariana. La OMS aconseja evitar por completo la lactancia materna solo si la lactancia artificial es aceptable, factible, asequible, segura y sostenible (AFASS).
Material y métodos: se analizaron datos de tres programas del Ministerio de Salud para la prevención de la transmisión vertical (PTV) del VIH, en la Provincia Central de Kenia.
Las gestantes VIH+ recibieron información y consejo sobre cómo proteger al bebé durante el embarazo, el parto y el periodo de lactancia. Se administró zidovudina (AZT) desde la vigésimo octava semana, más nevirapina –dosis única– (SD-NVP) intraparto si los linfocitos CD4 eran mayores de 350 cel/mm3, o tratamiento antirretroviral de gran actividad (TARGA) si eran menores de 350 cel/mm3. Los neonatos expuestos recibieron AZT + NVP. Se suministró lactancia artificial (LA), filtros de agua y termos a las madres que optaron por no lactar a sus hijos. Se realizó reacción en cadena de la polimerasa (PCR) para ADN-VIH-1 a las seis semanas de vida. Las madres incluidas en el programa recibían apoyo psicológico individualizado y a través de terapias de grupo.
Resultados: la mayoría de las madres (66-96%) se decidieron por la LA; 881 lactantes recibieron leche artificial bien desde el nacimiento o tras un periodo inicial con lactancia materna o con leche de vaca; 515 (58%) fueron dados de alta a los seis meses de edad; 272 (31%) permanecían en el programa (niños < 6 meses) en el momento del análisis de datos. Hubo 59 (6,7%) pérdidas de seguimiento y 12 (1,4%) traslados a otros programas. Un total de 23 (2,6%) lactantes fallecieron.
Los neonatos infectados por VIH tuvieron diez veces más probabilidades de morir antes de cumplir seis meses que los no infectados (odds ratio [OR]: 10,55; IC 95% [intervalo de confianza del 95%]: 2,51-41,5), p < 0,001).
La morbilidad fue baja; la incidencia de diarrea y de infecciones respiratorias fue de 15,3 y de 42,4 por cada 100 personas/año, respectivamente.
Conclusiones: es factible y seguro apoyar la lactancia artificial para madres seropositivas y sus bebés en entornos con escasos recursos en programas integrados en instituciones sanitarias del sector público.
Palabras clave
● Infección VIH ● Lactancia artificial ● Prevención ● Transmisión verticalIntroducción
Según los datos de ONU-SIDA sobre la epidemia de SIDA, se estima que aproximadamente 200 000 lactantes se infectan por el virus de la inmunodeficiencia humana (VIH-1) a través de la lactancia materna cada año1,2. La mitad de estos niños fallecerá antes de cumplir los dos años si no recibe tratamiento3. Alrededor del 90% de toda la población infantil VIH positiva vive en el África subsahariana. La transmisión vertical del VIH ha representado una proporción importante de la mortalidad en menores de cinco años y, en muchos países, el SIDA es causa de entre un 30% y un 50% de las muertes infantiles4. La eliminación de la infección pediátrica por el VIH produciría un gran incremento en la supervivencia infantil en los países afectados y sería crucial para la consecución de los objetivos de desarrollo del milenio 4 y 6, relacionados con la disminución de la mortalidad infantil y el control de la epidemia de SIDA.
La lactancia natural por parte de las madres infectadas con el VIH es responsable de hasta un 40% de las transmisiones verticales del virus5. Según la OMS, cuando la lactancia artificial (LA) es aceptable, factible, asequible, segura y sostenible (AFASS) se debe recomendar a las madres seropositivas que no den el pecho6.
Debido a la abstención de la lactancia materna (LM), la transmisión postnatal del VIH de madre a hijo es poco frecuente en países de renta media y alta7-10. Por el contrario, en las regiones con escasos recursos del África Subsahariana donde la epidemia de SIDA es mucho mas prevalente, la mayor parte de las madres con infección por VIH no reciben ninguna ayuda si deciden no amamantar a sus hijos, debido principalmente a la falta de fórmulas lácteas artificiales asequibles y a la preocupación por la seguridad de su uso11.
Se ha investigado bastante sobre la prevención de la transmisión vertical (PTV) del VIH en ciertas zonas de África, con respecto a la seguridad, aceptabilidad y factibilidad de la LA en sustitución de la leche materna. El tema de la asequibilidad suele enfocarse en términos de la capacidad de pago de los costes de la alimentación por parte de las madres. El tema de la sostenibilidad no se ha abordado directamente.
La aceptabilidad de la alimentación sustitutiva se pone en evidencia por la elección de muchas madres de dicha opción, entre un 49% y un 99%, en diferentes regiones12-17. La seguridad se ha demostrado en cohortes donde la mayoría de las madres tenía acceso a agua potable14,18-20, o donde se les suministraban filtros adecuados para purificar el agua21. Otro programa en Ruanda ha descrito la metodología para conseguir una alimentación sustitutiva segura mediante el suministro de estufas de queroseno para hervir el agua22.
Un estudio en Sudáfrica analizó la elección materna del tipo de alimentación infantil, en relación con criterios de aceptabilidad, seguridad y factibilidad de la leche artificial de sustitución, y encontró que la supervivencia infantil libre de contagio de VIH era óptima cuando se suministraba a madres con acceso a agua corriente, electricidad o gasóleo para cocinar y revelaban su estado VIH positivo dentro de las primeras tres semanas tras el parto19.
Previamente, hemos documentado la seguridad de la LA en lactantes expuestos al HIV en el contexto del programa integral del Ministerio de Salud de PTV en el distrito de Maragua, Kenia, una región empobrecida y sin agua potable, consiguiendo una baja morbimortalidad asociada con la LA23.
La asequibilidad depende principalmente del precio de la fórmula. Los programas nacionales para la PTV en Botsuana y Sudáfrica proveen de leche artificial gratis a las madres que optan por el reemplazo. En el caso de Botsuana, el programa nacional de PTV es una de las mejores prácticas en la lucha contra el SIDA24. En los demás países subsaharianos, aparte de intervenciones puntuales en ensayos clínicos o de ciertos programas de ayuda humanitaria financiados por donantes, el coste de la fórmula de reemplazo debe ser afrontado por las madres o familiares. La sostenibilidad de la LA para la mayoría de estas familias dependerá de su financiación por parte de los Ministerios de Salud.
A pesar de que la falta de higiene con morbimortalidad añadida en la administración de la leche artificial es el principal argumento en contra del apoyo de la LA para madres seropositivas en países de renta baja, no hemos encontrado ninguna publicación correspondiente a un programa rutinario del Ministerio de Salud de países africanos o ensayos clínicos en los que se hayan evaluado metodologías específicas para hacer la leche artificial más segura para madres seropositivas. Por el contrario, durante los últimos dos años se han publicado numerosos estudios realizados en África sobre cómo hacer la lactancia materna más segura para madres seropositivas mediante la administración de medicación antirretroviral (ARV) a la madre y/o al bebé durante el periodo de lactancia25-27 basados en la imposibilidad de dichos países de poner en marcha programas de LA segura. En las últimas recomendaciones de la OMS, de noviembre de 20096, se establece que en aquellos contextos donde la leche artificial no sea AFASS se debe administrar ARV a la madre y al bebé durante el periodo de lactancia. Esta recomendación contrasta con las últimas del Instituto Nacional de la Salud de EE. UU.28, donde la LM, con o sin ARV, se contraindica y no se considera segura debido fundamentalmente a la imposibilidad de eliminar la transmisión madre-hijo mediante esta estrategia y al desarrollo de resistencias a múltiples fármacos y familias de ellos observadas en los bebés infectados y expuestos a leche materna con ARV29-30. En España, las últimas recomendaciones para la PTV también incluyen la contraindicación de la lactancia materna31.
Kenia tiene una prevalencia de infección por VIH del 7,8% entre la edad de 15 y 49 años (KAIS, 2007). La tasa de mortalidad infantil (menores de un año) en 2009 fue de 52/1000 y la mortalidad en niños menores de cinco años de 74/100032.
El objetivo de este estudio es demostrar cómo, dentro del Sistema Público de Salud de Kenia, es posible aplicar las mejores prácticas en la eliminación de la transmisión postnatal (madre-hijo) del VIH y conseguir una supervivencia óptima para bebés nacidos de madres seropositivas.
Material y métodos
Se presenta un estudio retrospectivo de datos recogidos rutinariamente en tres programas de PTV, realizados por el Ministerio de Salud con ayuda de una ONG (Asociación Vihda), en la Provincia Central de Kenia, en concreto en los hospitales de distrito de Maragua (rural), Karatina (semiurbano) y Provincial de Nyeri (urbano). Se recogieron los datos entre el 4 de septiembre de 2005 y el 25 de julio de 2008.
Descripción del programa
Captación de madres y bebés
La “gestión de ventanilla única” para las gestantes VIH+ se realizó mediante la integración de todos los servicios en la “clínica antenatal” (CAN) de cada hospital evitando así referir a la madre a los diversos departamentos (consultas de VIH, farmacia, laboratorio, consulta de nutrición…).
En todo momento se siguió el protocolo nacional para la PTV. El análisis del VIH se ofreció en la CAN a todas las mujeres embarazadas (estrategia opt-out) y era voluntario; a las mujeres VIH+ se les realizó análisis de los linfocitos CD4 y se les suministró profilaxis o tratamiento antirretroviral según sus niveles de CD4: si CD4 > 350, zidovudina (AZT) desde la vigésimo octava semana, más nevirapina en dosis única (SD-NVP) intraparto; si el contaje de CD4 era < 350, tratamiento antirretroviral de gran actividad (TARGA).
A los recién nacidos se les administró SD-NVP dentro de las primeras 72 horas de vida, más AZT diario durante una semana. Este último se prolongaba hasta las cuatro semanas si la profilaxis antirretroviral de la madre había durado menos de cuatro semanas. Recientemente se ha introducido la profilaxis con AZT y 3TC a las madres y bebés durante una semana postparto tras la administración de SD-NVP para minimizar el desarrollo de resistencias.
En los centros urbano y semiurbano, los partos fueron gratis para las madres VIH+, y el gasto fue sufragado por la ONG. Tras el asesoramiento sobre las opciones de alimentación, a las madres que optaron por no amamantar a sus hijos se les proporcionó información por personal sanitario especializado y se las proveyó de leche artificial, filtros de cerámica para purificar el agua y termos para mantener el agua hervida.
La leche artificial se entregó y controló fuera del área de Salud Materno-Infantil, para proteger la promoción de la lactancia materna para la población general y evitar el riesgo de que las madres seronegativas se influenciaran por la práctica y dejaran de dar el pecho. En el centro semiurbano, la LA se integró dentro de un programa ya existente de cuidados domiciliarios del Ministerio de Salud.
Cada madre fue instruida por otra madre que previamente había alimentado a su hijo dentro del programa, y por trabajadores de salud, sobre cómo reconstituir adecuadamente la fórmula artificial mediante un kit de demostración.
Los volúmenes y la frecuencia de las tomas se especificaron según la edad del lactante. Se aleccionó cuidadosamente a las madres para que almacenaran en los termos únicamente agua previamente filtrada y hervida, y evitar así la necesidad de hervirla en cada toma, asegurar la higiene y facilitar el proceso de reconstitución de la leche artificial durante la noche o los desplazamientos.
Seguimiento
La intervención formó parte del programa rutinario del Ministerio de Salud e incluyó el control del crecimiento y desarrollo del bebé, vacunas, asesoramiento continuo sobre el VIH, monitorización y tratamiento de la infección materna por el VIH, profilaxis y tratamiento de las infecciones oportunistas en la madre y el hijo, planificación familiar y diagnóstico y tratamiento de infección por VIH en caso de que el lactante se infectara.
El apoyo psicosocial se ofreció a través de grupos regulares de ayuda formados por madres y padres. En el hospital semiurbano, por cada 20 mujeres se constituyó un grupo de ayuda, que se encargó incluso de detectar y asistir a las madres que no acudieron a la consulta de forma regular.
El entrenamiento individualizado en la técnica de alimentación infantil se realizó al menos mensualmente, hasta que los lactantes alcanzaron los seis meses de edad, con objeto de asegurar calidad, volúmenes e intervalos alimentarios adecuados.
A las seis semanas de edad se realizó, para todos los lactantes expuestos, la prueba de PCR para ADN-VIH-1. Los resultados se obtuvieron de gotas de sangre en papel de filtro, procesadas por los laboratorios de KEMRI (Kenyan Medical Research Institute) en Nairobi, dentro de la iniciativa “Diagnóstico precoz de la infección pediátrica por el VIH” financiada por la Fundación Clinton y los Centers for diseases control and prevention (CDC) estadounidenses.
Recogida de datos
En cada uno de los centros se registró de forma mensual la asistencia, el seguimiento clínico, la medicación recibida, el peso del lactante, y el grado de cumplimiento de la lactancia materna y artificial. La morbilidad durante los primeros seis meses de vida se evaluó a partir de preguntas directas sobre episodios de diarrea, enfermedad respiratoria, visitas a Urgencias u hospitalizaciones. La infección por VIH y el tratamiento de las madres se registraron mediante un software automatizado: FUCHIA® (Follow-up and care of HIV infection and AIDS, version 1.6.1.917, MSF-Epicentre, París).
Para los lactantes, una tarjeta estándar de “Cuidados del Niño Sano” sirvió como historia de cada paciente junto con un anexo específico donde registrar alimentación, ARV, resultados de la ADN-PCR y comentarios clínicos. Todos los datos se trasvasaron regularmente a una hoja de cálculo Excel®, convenientemente desvinculados de cualquier dato identificador personal, para los propósitos del análisis.
Análisis estadístico
Se utilizó una metodología estadística descriptiva para analizar las características basales en la población de estudio; el test de chi cuadrado para comparar proporciones y la prueba de la U de Mann-Whitney para las variables continuas no paramétricas. La asociación entre variables se estableció mediante el cálculo de las odds ratio (OR) con intervalos de confianza del 95%. Los test fueron de dos colas y se consideró significativo el valor de p < 0,05.
Resultados
En total, entre septiembre de 2005 y julio de 2008, 881 niños iniciaron LA, 709 de los cuales lo hicieron al nacer y 172 después de un periodo variable de alimentación materna o con leche de vaca (figura 1).
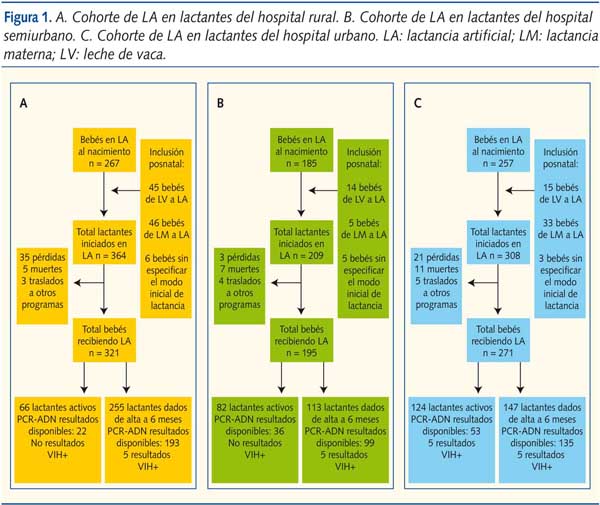
El seguimiento total fue de 325,2 personas/año. En un corte transversal de 12 meses de duración, el número de mujeres seropositivas que acudieron a la CAN y que optaron por la LA fue del 95,6% (85/88), del 66,1% (82/124) y del 92,8% (129/139) en los centros rural, semiurbano y urbano, respectivamente.
Se recabó información de las madres y sus prácticas de LA mediante los grupos de apoyo mutuo existentes en cada centro. De 148 mujeres encuestadas, 141 (95%) habían notificado su seropositividad para el VIH a la pareja. A un total de 183 mujeres se les preguntó si su pareja se había realizado el despistaje del VIH, habiéndoselo realizado el 73% (133). Se identificaron algunas diferencias en el acceso al agua potable en función del entorno donde vivían: entre las 176 mujeres a las que se encuestó sobre la calidad del agua en el hospital rural, solo 34 (19%) tenía acceso a agua potable, mientras que en los hospitales urbanos y semiurbanos agrupados conjuntamente, este porcentaje ascendía al 42% (30/71), a pesar de que la potabilidad no podía ser garantizada. Las prácticas de alimentación fueron similares en todos los centros analizados. A pesar de las recomendaciones de alimentar a los niños con una taza, de acuerdo a la política del Ministerio de Salud Pública y de UNICEF, el 88% de las madres consultadas (188/213) escogieron alimentar a sus hijos con biberón, adquirido por ellas mismas. El 95% de las madres (203/213) hervía agua para limpiar los utensilios de alimentación antes de usarlos.
La pérdida de seguimiento varió entre cada centro. La búsqueda de pacientes que no acudieron a la consulta fue muy efectiva en el centro correspondiente al área semiurbana (Karatina). Sin embargo, no existió ninguna estrategia de búsqueda en los centros correspondientes al área urbana (Nyeri) y rural (Maragua). Como consecuencia de ello, la tasa de pérdida de seguimiento varió entre las distintas cohortes, siendo significativamente más baja en la cohorte correspondiente al área semiurbana (tres de 209; 1,44%), respecto a las cohortes rural y urbana combinadas (56 de 672; 8,33%) (p < 0,001) (tabla 1).

Seguridad de la lactancia artificial durante los primeros seis meses de vida
Los datos de la morbilidad asociada para cada una de las tres cohortes se reflejan en la tabla 2.
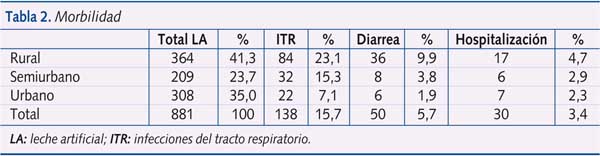
En la evaluación de las tres cohortes combinadas, hubo 50 episodios de diarrea, con una incidencia de 15,3 por 100 personas/año, y 138 episodios de infecciones del tracto respiratorio superior o inferior, con una incidencia de 42,4 por 100 personas/ año. Hubo 30 hospitalizaciones en total por distintas patologías consideradas graves (9,2 por 100 personas/año). La mortalidad durante los primeros seis meses de vida se evaluó a través de la búsqueda de pacientes y de la historia clínica. Fallecieron un total de 23 niños (7,1 por 100 personas/año), a 13 de los cuales se les había realizado una ADN-PCR del VIH, que fue positiva en cuatro casos. Las causas de muerte no siempre pudieron identificarse, pero las infecciones del tracto respiratorio constituyeron la causa más frecuente (12 casos). Se identificó un solo caso de muerte debida a diarrea. La mortalidad infantil fue similar en las tres cohortes analizadas: rural 5/332 (1,51%); semiurbana 7/206 (3,39%) y urbana 11/292 (3,76%).
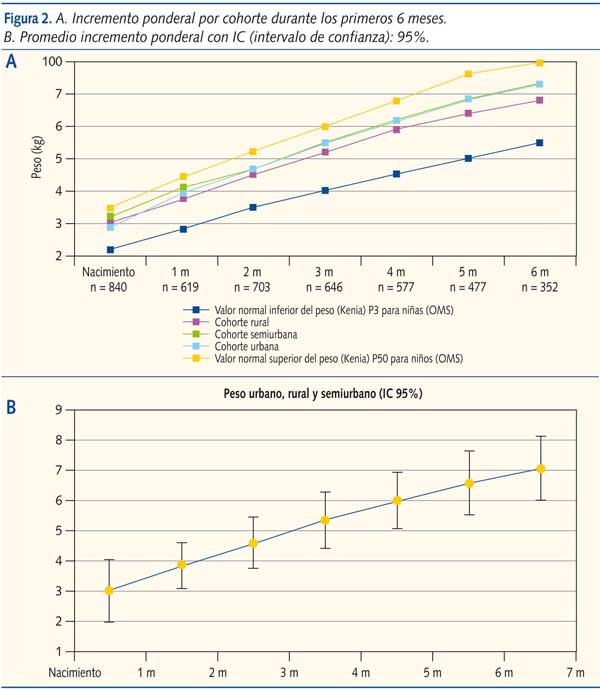
El peso de los niños fue monitorizado de forma mensual durante seis meses (figura 2A). El promedio de peso infantil de todos los centros (IC 95%), medido de forma mensual, osciló entre el percentil 3 y el 97 de la tabla de la OMS de peso por edad (figura 2B). La pendiente de la curva de incremento ponderal para cualquiera de las tres cohortes fue normal.
Transmisión del VIH
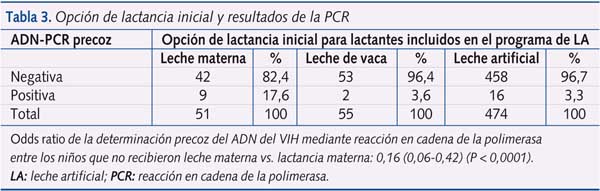
Se obtuvieron resultados del ADN del VIH por PCR a partir de las seis semanas de edad en un total de 582 niños alimentados con leche artificial (66% de toda la cohorte). La mayoría de los niños que no fueron testados (132 niños) fueron reclutados en el centro rural de Maragua, donde la determinación del ADN del VIH por PCR no estuvo disponible en la fase inicial del programa. El resto de los niños que no fueron testados fueron vistos en el centro urbano de Nyeri y semiurbano de Karatina (103 y 64 niños, respectivamente).
De los 582 niños con resultados de PCR, 475 (81,6%) recibieron una intervención que incluyó profilaxis antirretroviral a la madre y/o al niño, asistencia hospitalaria en el momento del parto y lactancia artificial desde el nacimiento, de los cuales seis (1,26%) tuvieron un resultado positivo de ADN-PCR. El análisis univariado de los resultados de ADN-PCR en función de la alimentación recibida (leche materna vs. leche artificial) confirmó que la administración de leche artificial o leche de vaca desde el nacimiento se asoció con una menor incidencia de transmisión del VIH en comparación con la lactancia materna (OR 0,16 [0,06-0,42]; p < 0,0001) (tabla 3). La mortalidad de los niños infectados por el VIH (4 de 27; 14,8%) fue sensiblemente superior a aquellos seronegativos por el virus (9 de 555; 1,6%) (OR 10,55 [2,51-1,5]; p < 0,001).
Análisis de coste
El coste de un año de LA adquirida al precio actual de mercado en Kenia es de 612 dólares estadounidenses (USD), impuestos incluidos. La revisión de las recomendaciones nacionales para el tratamiento del niño infectado por el VIH (abril de 2008) recomienda que todos los niños diagnosticados antes de los 12 meses de edad inicien tratamiento antirretroviral, independientemente del estadio clínico de la OMS o del recuento del porcentaje de linfocitos CD4. Se recomienda además que todos los niños expuestos previamente a la nevirapina –ya sea debido al tratamiento materno con dosis única de nevirapina o al TARGA de la madre, que la incluye– deben ser tratados con un régimen que incluya un inhibidor de la proteasa. La mayoría de madres en el África subsahariana incluidas en un programa de PTV reciben nevirapina en una de estas dos formas. El coste actual de un TARGA pediátrico con un régimen basado en lopinavir (potenciado con ritonavir), zidovudine y lamivudina es de 736 USD al año.
Discusión
Este estudio describe cómo mejorar las condiciones de administración de LA para prevenir el contagio postnatal del VIH y garantizar una supervivencia infantil óptima en tres programas del Sistema Público de Salud de la Provincia Central de Kenia. El programa rural fue el primero en ofrecer los servicios de ayuda integral a mujeres seropositivas y a sus bebés, incluyendo LA. Los programas en las localizaciones semiurbana y urbana se pusieron en marcha después, tras observar los buenos resultados del programa rural. El hecho de que sean programas rutinarios del Sistema Público de Salud y no ensayos clínicos supone una ventaja en la aplicación de estrategias eficaces a programas replicables y sostenibles33 y para llegar a las poblaciones más vulnerables.
El hecho de que entre un 66,1% y un 95,6% de mujeres seropositivas optaran por la LA como forma de alimentar a sus bebés confirma la alta tasa de aceptación de esta estrategia en una cohorte de madres seropositivas de la Provincia Central de Kenia. La mayoría de estas mujeres se registraron en las consultas antenatales de los tres hospitales, pero también hubo madres que acudieron desde otros distritos y, en algunos casos, desde otras provincias pues este tipo de apoyo no existía en sus lugares de origen.
Algunos autores han observado que las madres seropositivas sufren estigmatización si optan por no dar el pecho a sus bebés15. Nuestra experiencia sugiere que las madres seropositivas que optan por la LA demuestran haber aceptado su estatus de seropositividad y, además, la mayoría se lo han revelado a sus parejas. Este fenómeno también ha sido observado en un estudio realizado en Costa de Marfil34. Al apoyar a la madre en su decisión de no exponer al bebé al VIH a través de la leche materna se la anima a realizar acciones concretas contra el estigma y la marginación. Esto puede explicar el menor número de pérdidas de seguimiento en la cohorte de madres que optan por LA en comparación con madres que optan por dar el pecho en presencia de una alternativa35. El estigma y la marginación no implican necesariamente autodiscriminación36. Cuando las mujeres comparten su estado seropositivo con sus parejas se observa un doble efecto beneficioso: los maridos seronegativos tienen la posibilidad de protegerse frente a la infección y aquellos maridos infectados pueden registrarse antes en las consultas de VIH y empezar el tratamiento ARV a tiempo.
Algunos de los lactantes que recibieron LA no podrían haber sido alimentados con lactancia materna exclusiva, pues las madres padecían una enfermedad avanzada y carecían de leche suficiente para garantizarla37. Coovadia y cols. observaron que las madres que optaron por la LA tenían cifras de linfocitos CD4 más bajos que las madres que optaron por la lactancia materna38. También es posible que algunas madres seropositivas con varios bebés (gemelares, trillizos) no tuvieran leche suficiente para garantizar la lactancia materna exclusiva durante seis meses como se recomienda (37 bebés en nuestra cohorte). En una publicación oficial sobre la situación sanitaria en Kenia en el periodo 2008-2009 se menciona que solo un 13,2% de la población general consigue completar cinco meses de lactancia materna exclusiva32. Las consecuencias de la lactancia mixta (pecho y otros alimentos) son bien diferentes para lactantes expuestos al VIH comparados con lactantes no expuestos38. Un total de 21 madres fallecieron durante el parto o durante los primeros seis meses de vida del lactante. Un estudio en Zimbabue observó como la mortalidad materna en madres seropositivas con menos de 200 linfocitos CD4 era 54 veces mayor que en madres seronegativas39. Cuatro lactantes fueron abandonados al nacimiento y cuidados por otros familiares o por instituciones. Todos estos lactantes refuerzan la necesidad de tener LA como una opción disponible en todos los programas de PTV, e incluso en todos los hospitales e instituciones donde hay bebés huérfanos. Actualmente, la mayoría de estos lactantes en África reciben leche animal por falta de apoyo con leche artificial; la leche animal está contraindicada en lactantes menores de seis meses6. Aparte del hecho de una producción insuficiente de leche materna por aquellas madres seropositivas enfermas, también está el riesgo añadido de una mayor transmisión del VIH al tener cargas virales altas38,40. De un total de 627 madres con resultados de linfocitos CD4 disponibles, 114 tenían menos de 200 cel/mm3 (18,2%).
Mediante un apoyo integral a la madre, la LA segura puede convertirse en una opción factible en zonas de renta baja donde el agua potable no está disponible de forma generalizada. La metodología de administración de la leche artificial es crucial a la hora de garantizar buenos resultados. Los datos aquí presentados demuestran la seguridad en la administración de la leche artificial en las tres cohortes. Las tasas de mortalidad fueron bajas en los tres programas a pesar de que algunos lactantes no habían completado el protocolo de PTV en su totalidad. También se observaron tasas bajas de morbilidad.
En las tres cohortes descritas, las madres prefirieron alimentar a sus bebés con un biberón (88%) que con una taza, a pesar de que las recomendaciones nacionales desaconsejan el uso de biberones. El uso de biberones ha sido descrito en otros estudios con buenos resultados13,21. Un metaanálisis publicado por la Cochrane Collaboration en el año 2007 comparó el uso del biberón y la taza para alimentar a bebés que no podían recibir leche materna de forma exclusiva. Los autores observaron que el uso de la taza no aportaba ventajas en relación a ganancia de peso, estancia en el hospital o cualquier otra variable considerada, incluidas tasas elevadas de falta de cumplimiento41.
Las pérdidas de seguimiento fueron especialmente bajas (1,5%) en la cohorte semiurbana donde la LA se integró en un programa ya existente de cuidados domiciliarios del Ministerio de Salud. La búsqueda de las madres que dejaron de acudir a la consulta se realizó por otras madres del mismo grupo de terapia que vivían en la misma localidad. Las terapias de grupo mensuales incluyen también a las parejas y a los bebés de la misma edad y el apoyo mutuo se valoró de forma muy positiva por las madres y padres incluidos. Los datos sobre la transmisión del VIH sugieren que las tasas de infección precoz postnatal fueron muy bajas en la cohorte de lactantes alimentados con LA desde el nacimiento. Haber recibido leche materna de forma inicial se asoció con una tasa mayor de infección por el VIH en comparación con haber recibido leche artificial o leche de vaca. La lactancia mixta precoz combinando leche materna con otros alimentos se tradujo en cifras más altas de transmisión, debido a la mayor carga viral durante este periodo de alimentación y a la irritación gastrointestinal causada por la ingesta de otros alimentos aparte de leche materna. El test rápido de anticuerpos a los nueve meses de edad empezó a realizarse de forma rutinaria en el año 2008. De un total de 139 lactantes con ADN-PCR negativa a las seis semanas y test de anticuerpos disponibles a los nueve meses, solamente uno tuvo un resultado positivo. Estos resultados avalan el valor predictivo de una ADN-PCR negativa precoz en bebés no expuestos a leche materna.
Los programas de tratamiento de la infección por el VIH en la mayoría de los países de África subsahariana ya ofrecen terapia ARV gratuita para adultos y niños infectados por el VIH y también como parte de los programas de PTV. Sin embargo, el coste de proporcionar leche artificial para prevenir el contagio postnatal del VIH se ha considerado una responsabilidad de la madre. Este coste debería ser asumido por las mismas instituciones (programas nacionales e iniciativas internacionales) que proporcionan otros componentes del tratamiento de la infección VIH, vacunas, tratamiento de TB, planificación familiar, etc. y no por las propias madres. La gran mayoría de estas madres carecen de los recursos necesarios para comprar la leche artificial, resultando en más infecciones pediátricas por el VIH. Cuando una madre seropositiva decide no dar el pecho a su bebé, está hablando del derecho fundamental del niño a no ser expuesto al VIH. Este derecho solo se puede garantizar mediante apoyo integral a la madre42.
Recientemente, se han publicado varios estudios tratando de hacer la lactancia materna más segura para bebés expuestos al VIH mediante la administración de ARV y proteger a la población general frente al uso de leche artificial25-27. Varios programas nacionales en África están invirtiendo actualmente recursos muy significativos para poner en marcha estas recomendaciones. Estas estrategias están contraindicadas en países de renta media y alta debido a la imposibilidad de eliminar la transmisión del VIH comparado con la LA, al desarrollo de resistencias en la madre y el hijo y al hecho de que hay bebés que no pueden tomar el pecho por enfermedad o fallecimiento de la madre y necesariamente tienen que alimentarse con leche artificial. Estos países han invertido en hacer la LA segura como solución a corto y largo plazo. A medida que los países menos desarrollados mejoran sus condiciones de vida, como es el caso de Kenia, más y más programas adoptarán el mismo modelo de garantizar la supervivencia del bebé sin exponerlo a leche materna contaminada con VIH y proteger a la vez la promoción de la lactancia materna en la población general. Invertir recursos en la estrategia de lactancia materna con ARV sin hacer lo mismo en conseguir una LA segura para lactantes huérfanos, abandonados y nacidos de madre seropositiva es un buen ejemplo de “pan para hoy y hambre para mañana” y refleja la enorme desigualdad entre acceso a medicina de calidad para bebés expuestos al VIH nacidos en países de renta baja en comparación con países de renta media y alta; lo que en países de renta baja se recomienda, en países de renta media y alta se contraindica, y se perpetúa el ciclo de pobreza-enfermedad.
Nosotros creemos que no es sostenible ofrecer asistencia médica integral incluyendo TARGA a niños infectados por el VIH, con o sin cepas resistentes, como consecuencia de programas deficientes de PTV, sin previamente haber invertido lo suficiente en evitar esas mismas infecciones.
La escasez de programas de LA para madres seropositivas africanas que optan por no dar el pecho puede hacer pensar que en estos contextos no se dan las condiciones necesarias para garantizar una LA segura y eficaz. Al proporcionar apoyo integral a las madres seropositivas y a las instituciones públicas se pueden modificar las condiciones para conseguir cumplir los criterios AFASS dentro del sistema público de salud, y beneficiar además a todos los bebés que no pueden tomar el pecho por enfermedad o falta de la madre.
Agradecimientos
Los autores quieren dar las gracias al personal sanitario del Ministerio de Salud de Kenia que trabaja en los programas de PTV en los hospitales de Maragua, Karatina y Nyeri y en el centro de asistencia domiciliaria de Karatina por su dedicación para conseguir una generación de niños sin VIH en Kenia. Queremos agradecer la determinación de las madres y padres incluidos en el programa para proteger la salud de sus hijos y luchar contra el estigma asociado a la enfermedad. Agradecer también a Elia Pérez y Belén San José, del Servicio de Bioestadística del Hospital Universitario de La Paz de Madrid, su ayuda con el análisis estadístico de los datos, y al Dr. Rumunyu Mwangi, coordinador provincial de SIDA de la Provincia Central de Kenia. También agradecer al Dr. Enrique Rodríguez-Salinas su apoyo y colaboración en la finalización y envío del artículo.
Este programa ha sido posible gracias al apoyo financiero del Ministerio de Asuntos Exteriores español a través de la Agencia Española de Cooperación Internacional y para el Desarrollo (AECID) y del Gobierno de Kenia.
Bibliografía
- HIV transmission through breastfeeding: a review of available evidence. Geneva: World Health Organization; 2007.
- AIDS epidemic update. Geneva: Joint United Nations Programme on HIV/AIDS; 2007.
- Newell ML, Coovadia H, Cortina-Borja M, Rollins N, Gaillard P, Dabis F. Mortality of infected and uninfected infants born to HIV-infected mothers in Africa: a pooled analysis. Lancet. 2004;364:1236-43.
- Stanecki KA. The AIDS Pandemic in the 21.st Century. U.S. Census Bureau, International Population Reports WP 02-2. Washington DC: U.S. Government Printing Office; 2004.
- Mofenson LM. Antiretroviral prophylaxis to reduce breast milk transmission of HIV type 1: new data but still questions. J Acquir Immune Defic Syndr. 2008;48:237-40.
- Use of antiretroviral drugs for treating pregnant women and preventing HIV infection in infants. Rapid advice on infant feeding and HIV. Geneva: World Health Organization; 2009.
- European Collaborative Study. Mother-to-Child Transmission of HIV Infection in the Era of Highly Active Antiretroviral Therapy. Clin Infect Dis. 2005;40:458-65.
- Townsend CL, Cortina-Borja M, Peckham CS, de Ruiter A, Lyall H, Tookey PA. Low rates of mother-to-child transmission of HIV following effective pregnancy interventions in the United Kingdom and Ireland, 2000-2006. AIDS. 2008; 22:973-81.
- Navér L, Lindgren S, Belfrage E, Gyllensten K, Lidman K, Gisslén M, et al. Children born to HIV-1-infected women in Sweden in 1982-2003: trends in epidemiology and vertical transmission. J Acquir Immune Defic Syndr. 2006;42:484-9.
- Talawat S, Dore GJ, Le Coeur S, Lallemant M. Infant feeding practices and attitudes among women with HIV infection in northern Thailand. AIDS Care. 2002;14:625-31.
- Coutsoudis A, Goga AE, Rollins N, Coovadia HM; Child Health Group. Free formula milk for infants of HIV-infected women: blessing or curse? Health Policy Plan. 2002;17:154-60.
- De Paoli M, Manongi R, Klepp KI. Are infant feeding options that are recommended for mothers with HIV acceptable, feasible, affordable, sustainable and safe? Pregnant women’s perspectives. Public Health Nutr. 2004;7:611-9.
- Leroy V, Sakarovitch C, Viho I, Becquet R, Ekouevi DK, Bequet L, et al. Acceptability of formula-feeding to prevent HIV postnatal transmission, Abidjan, Cote d’Ivoire: ANRS. Ditrame Plus Study. J Acquir Immune Defic Syndr. 2007;44:77-86.
- Coetzee D, Hilderbrand K, Boulle A, Draper B, Abdullah F, Goemaere E. Effectiveness of the first district-wide programme for the prevention of mother-to-child transmission of HIV in South Africa. Bull World Health Organ. 2005;83:489-94.
- Doherty T, Chopra M, Nkonki L, Jackson D, Greiner T. Effect of the HIV epidemic on infant feeding in South Africa: “When they see me coming with the tins they laugh at me”. Bull World Health Organ. 2006;84:90-6.
- Palombi L, Marazzi MC, Voetberg A, Magid MA. Treatment acceleration program and the experience of the DREAM program in prevention of mother-to-child transmission of HIV. AIDS. 2007;21 Suppl 4:S65-71.
- Njom Nlend A, Penda I, Same Ekobo C, Tene G, Tsague L. Is exclusive artificial feeding feasible at 6 months post partum in Cameroon urban areas for HIV-exposed infants? J Trop Pediatr. 2007;53:438-9.
- Becquet R, Bequet L, Ekouevi DK, Viho I, Sakarovitch C, Fassinou P, et al. Two-year morbidity-mortality and alternatives to prolonged breast-feeding among children born to HIV-infected mothers in Cote d’Ivoire. PLoS Med. 2007;4:e17.
- Doherty T, Chopra M, Jackson D, Goga A, Colvin M, Persson LA. Effectiveness of the WHO/UNICEF guidelines on infant feeding for HIV-positive women: results from a prospective cohort study in South Africa. AIDS. 2007;21:1791-7.
- Magoni M, Bassani L, Okong P, Kituuka P, Germinario EP, Giuliano M, et al. Mode of infant feeding and HIV infection in children in a program for prevention of mother-to-child transmission in Uganda. AIDS. 2005;19:433-7.
- Marazzi MC, Guidotti G, Liotta G, Palombi L. Community of Sant’ Egidio. DREAM: An integrated faith-based initiative to treat HIV/AIDS in Mozambique. Perspectives and practice in antiretroviral treatment. Geneva: World Health Organization; 2005.
- Farmer PE, Nizeye B, Stulac S, Keshavjee S. Structural violence and clinical medicine. PLoS Med. 2006;3:e449.
- Mugo P, Rumunyu M, Nzioka G, Torres V, Kamande M, Githinji J, et al. Safety and efficacy of a replacement feeding program in prevention of mother to child transmission of HIV in a resource limited setting: the experience of Maragua District, Central Province Kenya. 4.th IAS Conference, Sydney 2007. Abstract TUPEB107 [consultado el 20/09/2010]. Disponible en http://ias2007.org/pag/Abstracts.aspx?AID=4718.
- Progress report of the national response to the 2001 declaration of commitment on HIV and AIDS. Botswana country report 2010 [consultado el 20/09/2010]. Disponible en http://data.unaids.org/pub/Report/2010/botswana_2010_country_progress_report_en.pdf.
- Chasela CS, Hudgens MG, Jamieson DJ, Kayira D, Hosseinipour MC, Kourtis AP, et al. Maternal or infant antiretroviral drugs to reduce HIV-1 transmission. N Engl J Med. 2010;362: 2271-81.
- Kilewo C, Karlsson K, Ngarina M, Massawe A, Lyamuya E, Swai A, et al. Prevention of mother-to-child transmission of HIV-1 through breastfeeding by treating mothers with triple antiretroviral therapy in Dar es Salaam, Tanzania: the Mitra Plus study. J Acquir Immune Defic Syndr. 2009;52:406-16.
- Becquet R, Ekouevi DK, Arrive E, Stringer JS, Meda N, Chaix ML, et al. Universal antiretroviral therapy for pregnant and breast-feeding HIV-1-infected women: towards the elimination of mother-to-child transmission of HIV-1 in resource-limited settings. Clin Infect Dis. 2009;49:1936-45.
- Panel on Treatment of HIV-Infected Pregnant Women and Prevention of Perinatal Transmission. Recommendations for use of antiretroviral drugs in pregnant HIV-1-infected women for maternal health and interventions to reduce perinatal HIV transmission in the United States. May 24, 2010; pp 1-117 [consultado el 20/09/ 2010]. Disponible en http://aidsinfo.nih.gov/ContentFiles/PerinatalGL.pdf.
- Zeh C, Weidle P, Nafisa L, Musuluma H, Okonji J, Anyango E. Emergence of HIV-1 drug resistance among breastfeeding infants born to HIV-infected mothers taking antiretrovirals for prevention of mother-to-child transmission of HIV: The Kisumu Breastfeeding Study, Kenya. In: Program and abstracts of the 15.th Conference on Retroviruses and Opportunistic Infections, Boston, MA; February 3-6;2008:102.
- Lidstrom J, Guay L, Musoke P, Owor M, Onyango-Makumbi C, Church J, et al. Multi-class drug resistance arises frequently in HIV-infected breastfeeding infants whose mothers initiate HAART postpartum. In: Program and abstracts of the17.th Conference on Retroviruses and Opportunistic Infections, San Francisco; February 16-19;2010:433.
- Prieto Tato LM, Guillén Martín S, Ramos Amador JT. VIH. Prevención de la transmisión vertical (profilaxis posnatal con antirretrovirales) (v.1.1/2010). Guía-ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [actualizado el 31/08/ 2010; consultado el 14/09/2010]. Disponible en www.guia-abe.es.
- Kenyan National Bureau of Statistics (KNBS) and ICF Macro. 2010. Kenya Demographic and Health Survey 2008-09. Calverton, Maryland: KNBS and ICF Macro; 2010.
- John-Stewart GC. When is replacement feeding safe for infants of HIV-infected women? PLoS Med. 2007;4:e17.
- Brou H, Djohan G, Becquet R, Allou G, Ekouevi DK, Viho I, et al. When do HIV-infected women disclose their HIV status to their male partner and why? A study in a PMTCT programme, Abidjan. PLoS Med. 2007;4:e342.
- Torres V, Wachira M, Jaen A, Bedell R. Impacto de un programa de asistencia integral a mujeres embarazadas seropositivas y prevención de la transmisión vertical del VIH en la Provincia Central de Kenia. XII Congreso Nacional sobre el SIDA. Santiago de Compostela 16-18 Junio 2010. CO4.1.
- Mahajan AP, Sayles JN, Patel VA, Remien RH, Sawires SR, Ortiz DJ, et al. Stigma in the HIV/AIDS epidemic: a review of the literature and recommendations for the way forward. AIDS. 2008;22 Suppl 2: S67-79.
- Heird WC. The feeding of infants and children. In: Kliegman RM, Jenson HB, Behrman RE, Stanton BF (eds.). Nelson Textbook of Pediatrics, e-dition. 18.th ed. Philadelphia: Saunders Elsevier; 2007.
- Coovadia HM, Rollins NC, Bland RM, Little K, Coutsoudis A, Bennish ML, et al. Mother-to-child transmission of HIV-1 infection during exclusive breastfeeding in the first 6 months of life: an intervention cohort study. Lancet. 2007;369:1107-16.
- Hargrove JW, Humphrey JH; ZVITAMBO Study Group. Mortality among HIV-positive postpartum women with high CD4 cell counts in Zimbabwe. AIDS. 2010;24:F11-4.
- Kuhn L, Sinkala M, Kankasa C, Semrau K, Kasonde P, Scott N, et al. High uptake of exclusive breastfeeding and reduced early post-natal HIV transmission. PLoS One. 2007;2:e1363.
- Flint A, New K, Davies MW. Cup feeding versus other forms of supplemental enteral feeding for newborn infants unable to fully breastfeed. Cochrane Database of Systematic Reviews 2007, Issue 2. Art. No.: CD005092. DOI: 10.1002/14651858.CD005092.pub2.
- Msellati P, Van de Perre P. Maternal HIV infection and infant feeding: support is the key. AIDS. 2008;22:2391-2.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.





