Vol. 14 - Num. 54
Pediatría Basada en la Evidencia
¿Qué puede aportar el tratamiento con melatonina a niños mayores y adolescentes con retraso de inicio de sueño?
Domingo Barroso Espaderoa, Ramón Ugarte Libanob
aPediatra. CS Cáceres-Mejostilla. Área Sanitaria de Cáceres. Cáceres. España.
bPediatra. CS Olaguibel. Servicio Vasco de Salud-Osakidetza. Vitoria-Gasteiz. Álava. España.
Correspondencia: D Barroso. Correo electrónico: pediatricworld@aol.com
Cómo citar este artículo: Barroso Espadero D, Ugarte Libano R. ¿Qué puede aportar el tratamiento con melatonina a niños mayores y adolescentes con retraso de inicio de sueño? Rev Pediatr Aten Primaria. 2012;14:167-77.
Publicado en Internet: 09-07-2012 - Número de visitas: 19785
Resumen
Conclusiones de los autores: la melatonina demostró eficacia (parámetros de sueño) en escolares y adolescentes con retrasos de fase, adelantando el inicio, acortando la latencia y otros. Parece mayor el efecto administrando el fármaco en horas tempranas. Hubo pocos efectos adversos, ninguno de importancia. En vigilia (cognición, estado general, ánimo…), se encontraron pocas mejoras.
Comentario de los revisores: los resultados prueban que la melatonina superó al placebo. Podría usarse, en casos seleccionados, con retrasos crónicos de la hora de inicio del sueño. Beneficio pequeño (dudosa significancia clínica) y desaparece tras periodos cortos de tratamientos. Faltan datos específicos para retrasos elevados de la hora de inicio del sueño. Aún no queda probado lo siguiente: tratamientos prolongados (seguridad, etc.), beneficios en vigilia, recomendar administración temprana.
Las evidencias proceden de pocos estudios con muestras pequeñas; muchas procedentes de niños no sanos (elevados porcentajes de trastorno por déficit de atención e hiperactividad, comorbilidades y tratamientos estimulantes).
Palabras clave
● Adolescente ● Melatonina ● Niño ● Trastornos del ritmo circadiano del sueño ● Trastornos del sueño ● TratamientoNota:
Este artículo se publica simultáneamente con la revista electrónica Evidencias en Pediatría (www.evidenciasenpediatria.es).
ESCENARIO CLÍNICO
Consultan unos padres cuyo hijo de 12 años tiene problemas para quedarse dormido a una hora apropiada. No suele dormirse hasta la una de la madrugada aunque se acueste sobre las 22:00 horas. Es un niño sano, le va bien en el colegio, no tiene problemas de comportamiento, es deportista y no tiene antecedentes médicos relevantes (adenoidectomía a los tres años, sin problemas respiratorios desde entonces). Exploración física sin nada llamativo: tensión arterial normal, índice de masa corporal (IMC) en percentil 45, Tanner P2-3/G3. Tras evaluar hábitos relacionados con horarios e higiene del sueño, mediante cuestionario a padres y al niño, y seguimiento durante tres semanas con agenda del sueño, nos encontramos con que al niño le cuesta quedarse dormido antes de la hora que indican, pero una vez dormido el sueño nocturno no muestra problemas. Tiene que madrugar los días de colegio para acudir a un centro escolar emplazado a 70 km de casa (hora de levantarse 06:30) y es frecuente que presente síntomas de falta de sueño en las primeras horas de la mañana, pero solo los días de colegio. Por la tarde: dos horas diarias de actividades extraescolares (incluyendo entrenamiento de baloncesto dos días a la semana de 18:30 a 20:00). Suele pasar las horas previas a quedar dormido conectándose a Internet. Los padres creen que su hijo “necesita medicamentos para ayudarle a dormir”. Han oído hablar de la melatonina y han visto en Internet “que se está usando para el insomnio en los niños”.
PREGUNTA CLÍNICA
¿Es eficaz la melatonina para el tratamiento del insomnio por retrasos del inicio de sueño, en escolares mayores y adolescentes sanos?
BÚSQUEDA BIBLIOGRÁFICA
Se realiza la búsqueda el 30 febrero de 2012.
- MEDLINE (PubMed/MEDLINE). Descriptores: Child; Female; Humans; Male; Melatonin/administration & dosage/therapeutic use/adverse effects; Sleep/drug effects/drug therapy/therapeutic use/therapy; Sleep Disorders/drug therapy; Sleep Initiation and Maintenance Disorders/drug therapy; Randomized Controlled Trials as Topic; Clinical Trials as Topic; Circadian Rhythm/drug therapy/therapy; Sleep Deprivation/drug therapy.
- Metabuscador TRIP (http://tripdatabase.com). Estrategia de búsqueda: (sleep OR insomnia) AND (child* OR adolescen* OR pediatri*) AND melatonin, seleccionando la opción "title" y aplicando los siguientes filtros: "systematic reviews" y " guidelines".
- EMBASE (1980-2011). Estrategia de búsqueda: (sleep disorders OR insomnia OR sleep) AND melatonin AND (children OR pediatric OR adolescent).
- The Cochrane Library Plus (Register of Systematic Reviews): [(MELATONIN OR MELATONINA) AND (SLEEP OR SLEEP DISORDER* OR INSOMNIA) AND (CHILD* OR PEDIATRI* OR ADOLESCEN*)]: TI.
Tras revisar las referencias recuperadas, se encuentran dos artículos1-2 de interés para responder a nuestra pregunta.
RESUMEN ESTRUCTURADO DE LOS ARTÍCULOS SELECCIONADOS
van Geijlswijk IM, Korzilius HPLM, Smits MG. The use of exogenous melatonin in delayed sleep phase disorder: a meta-analysis. SLEEP. 2010;33:1605-14.
Objetivo: valorar la eficacia y la seguridad de la melatonina exógena para adelantar el ritmo sueño-vigilia en pacientes con insomnio por retraso de fase de sueño.
Diseño: metaanálisis de ensayos clínicos aleatorizados y controlados con placebo.
Fuentes de datos: PubMed, Embase y resúmenes de sociedades de sueño y cronobiología (1990 hasta septiembre de 2009). No se aportaron los descriptores y estrategias de búsqueda empleados y se imitó por idioma (inglés). Se realizó búsqueda complementaria revisando las listas de referencias de los artículos originalmente encontrados. No se completó la búsqueda en fuentes de posibles estudios no publicados.
Selección de los estudios: ensayos clínicos aleatorizados (ECA), con doble cegamiento y controlados con placebo.
Criterios de inclusión: tenían que estar realizados en individuos con retraso de fase de sueño (SRF; delayed sleep phase disorder [DSPD]) y reunir los siguientes requisitos: a) comparación de melatonina con placebo; b) presentar resultados en salud expresados en, al menos, uno de los siguientes parámetros: inicio del ascenso de melatonina con la atenuación vespertina de la luz (dim light melatonin onset [DLMO]), hora de inicio del sueño (Sleep Onset time [SO/SOT]), hora de despertar (wake-up time [WUT]), latencia de inicio de sueño (sleep onset latency [SOL], definido como el tiempo que transcurre desde que se acuesta y apaga la luz, con intención de dormir, hasta el momento en que realmente se inicia el sueño nocturno), y el tiempo total de sueño (TTS), es decir, el tiempo transcurrido entre el SO y el WUT); y c) solo se incluyeron en el análisis aquellos estudios que hacían mención expresa de la relación entre momento de administración de la melatonina exógena y la hora correspondiente del ciclo del reloj interno circadiano (momento relativo a la hora del aumento de la melatonina endógena). Excluyeron estudios en pacientes con insomnio secundario y con patologías de base (sin embargo, no excluyeron estudios con pacientes diagnosticados de trastorno por déficit de atención e hiperactividad [TDAH]).
Los autores excluyeron también estudios que investigaban otros resultados clínicos, como por ejemplo la calidad del sueño, la calidad de vida global y otros parámetros relativos a mejoría en horas activas diurnas, o que únicamente estudiaron parámetros bioquímicos.
Se aceptaba la presencia de medidas no medicamentosas habituales (higiene del sueño…) como cointervención. No se permitía el uso de otros medicamentos para el tratamiento del insomnio.
De 182 estudios se excluyeron 173. Un total de nueve ECA cumplían los criterios de inclusión, de ellos uno fue excluido por población con comorbilidad y se incluyó otro externo de la lista de referencias. De ellos, cinco ECA incluyeron adultos exclusivamente, los otros cuatro fueron estudios pediátricos. No se refiere que se llevara a cabo un estudio de homogeneidad.
Extracción y síntesis de datos: estas tareas fueron realizadas por alguno de los investigadores por separado, siendo revisadas posteriormente por otro investigador distinto. La validez interna fue evaluada mediante la aplicación de la escala de Jadad y la puntuación obtenida en el cuestionario QA (Dwon & Black). Esta valoración se realizó por dos revisores de forma independiente. No se menciona el método de resolución de desacuerdos en la evaluación de la validez interna. De cada uno de los estudios se extrajeron, aparte del tipo de estudio y el número de pacientes para los grupos de tratamiento y placebo, datos correspondientes a variaciones tras intervención en los siguientes parámetros del sueño: DLMO, hora de inicio del sueño nocturno SO, WUT, SOL y TTS. Las diferencias de medias (DM) e intervalos de confianzas del 95% (IC 95%) extraídos para cada parámetro se presentan en figuras del metaanálisis. Otros datos seleccionados fueron los efectos adversos, dosis de melatonina, hora de administración del fármaco, y duración del periodo de tratamiento.
La variable principal fue la medición de cambios obtenidos, antes y después de la intervención, para al menos uno de los parámetros de sueño enumerados anteriormente. Se calcularon las medias de las diferencias combinadas y sus correspondientes IC 95%. Para combinar los resultados se empleó un modelo estadístico de tipo aleatorio. Tanto en los estudios en paralelo como en los estudios cruzados se valoraron los cambios respecto al valor basal.
Evaluación de la validez interna: los nueve estudios incluidos en el metaanálisis estuvieron por encima del punto de corte de calidad (> 3) en la escala de Jadad. Las puntuaciones medias fueron: cuatro sobre cinco en la escala de Jadad (rango 3-5) y de 26 sobre 32 (rango 19-31) en la escala de puntuación de Downs y Black. Las puntuaciones individuales alcanzadas por cada uno de los estudios en la escala de Jadad no constan en el artículo. La puntuación en la escala QA (Dwon & Black) para los ECA pediátricos fue siempre ≥ 28 (rango: 28-31).
Resultados principales: los autores combinaron resultados, procedentes de estudios pediátricos junto con los realizados en individuos adultos pero también nos ofrecen datos de una evaluación separada de estudios pediátricos y no pediátricos (ninguno de los estudios incluidos en el metaanálisis agrupaba pacientes adultos y pediátricos conjuntamente). Aquí mostramos los resultados del metaanálisis, en primer lugar los obtenidos para la combinación de estudios en adultos y niños y después los resultados obtenidos para la combinación de datos de los estudios pediátricos (lo resumimos también en la Tabla 1, donde además reflejamos los resultados obtenidos para la combinación exclusiva de ECA en pacientes adultos).
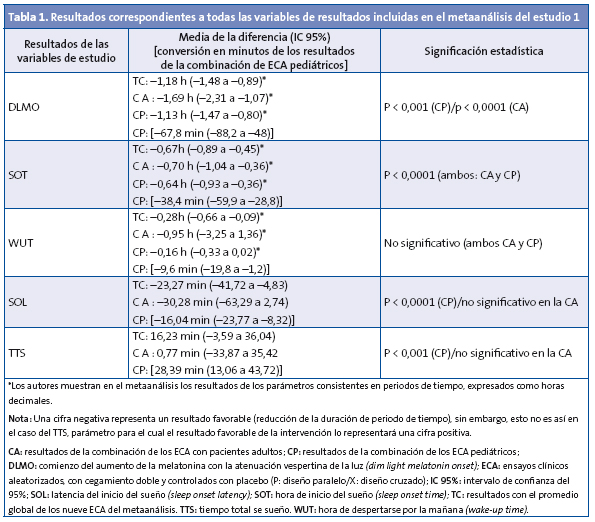
Los cuatro estudios con niños3-6 de este metaanálisis incluyeron en total 226 pacientes, con edades comprendidas entre 6 y 14 años. Los tamaños de las muestras estuvieron entre 19 y 105. Los porcentajes de pérdidas en tres de estos ECA pediátricos estuvieron entre el 0 y el 5%. El otro ECA4 mostró un 11,4% de pérdidas. Cinco de los ECA del metaanálisis eran estudios cruzados (cuatro en adultos y un ECA pediátrico). En el ECA pediátrico, con un diseño cruzado, los participantes recibían melatonina o placebo durante dos periodos de diez días separados por un periodo de blanqueo de cinco días. Los otros tres ECA pediátricos fueron diseños en paralelo, con periodos de duración de la intervención de cuatro semanas. La cifra total de pacientes en los ECA pediátricos del metaanálisis con TDAH fue de ≥ 160 de los 226 (es decir, al menos un 70,79% de la muestra pediátrica del metaanálisis). El rango de horas de administración de melatonina fue muy amplio, y las dosis de este medicamento que se usaron fueron muy diversas (aunque siempre dentro del rango terapéutico admitido hasta entonces).
Todos los ECA en niños mostraron que melatonina conseguía mejores resultados que el placebo.
En la Tabla 1 se muestran todos los resultados correspondientes a todas las variables de resultados incluidas en el metaanálisis (procedentes tanto de la combinación de los nueve ECA, como de las combinaciones separadas para estudios en adultos o para estudios pediátricos). Para la combinación de los ECA pediátricos todos los parámetros, menos uno (WUT), mostraron resultados estadísticamente significativos. Para la combinación de los estudios en adultos los resultados de los siguientes parámetros no alcanzaron significación estadística: WUT, SOL y TTS. Los resultados promedios para cada uno de los parámetros estudiados en el metaanálisis (combinación de los nueve ECA) fueron los siguientes: DLMO: acortamiento de 1,18 horas; SOT: acortamiento de 0,67 horas; WUT: acortamiento de 0,28 horas; SOL: acortamiento en 23,27 minutos, y TTS: incremento en 16,23 minutos (ver intervalos de confianza y otros datos en la Tabla 1).
El análisis de los estudios en niños mostró que la administración de la melatonina exógena logró un avance del comienzo del sueño (SO) en una media de 38,4 minutos (IC 95%: 28,8 a 59,9 minutos). La melatonina disminuyó la latencia hasta el comienzo del sueño (SOL) en una media de 23,27 minutos (IC 95%: 4,83 a 41,72).
Otros resultados distintos a los principales: no pudo confirmarse estadísticamente (p = 0,307) la hipótesis de que la administración precoz de la melatonina incrementa sus propiedades cronobiológicas (estudiado mediante la determinación del momento de ocurrencia del DLMO).
En el artículo no se realizó un análisis separado para los estudios pediátricos en lo referente a efectos adversos (EA) y perfil de seguridad (datos en la Tabla 1). El principal efecto adverso (hasta un 6 o 7% del total) fue la aparición de cefaleas. Otros efectos adversos fueron: sensación de disminución de apetito y mareo (Smits 20034, van der Heijden5).
Conclusión de los autores del metaanálisis: la melatonina exógena resulta efectiva en trastornos por retraso de fase para lograr adelantos tanto en los ritmo de sueño-vigilia como en los ritmos de secreción de la melatonina endógena.
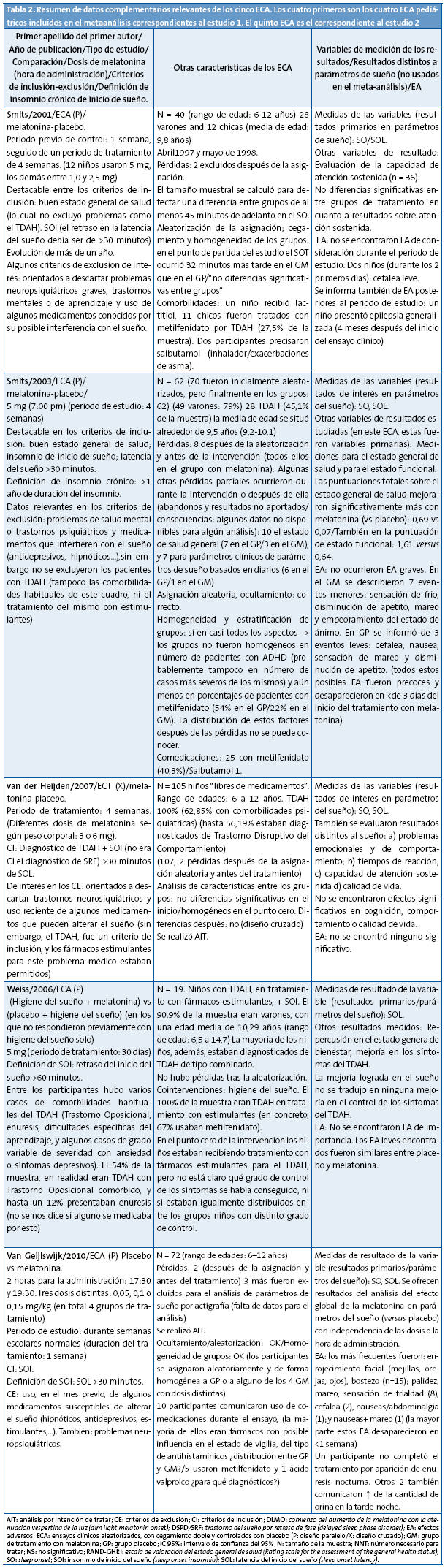
Hemos revisado los cuatro ECA pediátricos incluidos en este metaanálisis en búsqueda de información adicional útil referida a los siguientes aspectos de interés clínico: definición del problema que se utilizó, criterios de inclusión, efectos adversos, análisis de cointervenciones, estudio de efectos de la intervención en horas de vigilia (repercusión en el estado general de salud, en el estado de ánimo, o en la cognición) y características de los pacientes. Algunos de estos datos se ofrecen en la Tabla 2.
Conflicto de intereses/financiación: los autores declaran que el metaanálisis no estaba financiado por la industria y afirman no presentar ninguno de ellos conflicto de intereses.
Tres de los cuatro ECA pediátricos del metaanálisis procedían del mismo equipo de investigadores y uno de los autores del metaanálisis era también el primer autor de dos de los ECA pediátricos seleccionados.
van Geijlswijk IM, van der Heijden KB, Egberts AC, Korzilius HP, Smits MG. Dose finding of melatonin for chronic idiopathic childhood sleep onset insomnia: an RCT. Psychopharmacology (Berl). 2010;212:379-91.
Tipo de estudio: ECA, controlado con placebo y doble cegamiento.
Objetivos del ECA: establecer, en niños con insomnio crónico de tipo de inicio de sueño (SOI crónico), la relación de dosis-respuesta entre la administración de melatonina y las modificaciones en el sueño (adelantando el tiempo de SO/reduciendo el SOL).
Emplazamiento: se realizó en un centro de referencia especializado en trastornos del sueño-vigilia y de cronobiología del sueño (centro de tercer nivel en hospital de referencia) de Holanda.
Población de estudio: 72 niños con rango de edades: 6-12 años y SOI crónico.
La descripción de los pacientes incluidos, criterios de inclusión y otros detalles se describen en la Tabla 2. Los pacientes fueron referidos desde consultas de Pediatría o psiquiatría. No se explica con detalle el modo de selección.
Intervención: melatonina versus placebo. Periodo de tratamiento de una semana (diseño paralelo). La descripción de grupos, número de pacientes y otras caracterícitcas de la intervención se recogen en la Tabla 2.
Mediciones para las variables de resultado: los resultados valorados fueron la mejoría del insomnio de inicio del sueño, usando para ello los siguientes parámetros del sueño: adelantamiento logrado para el SO, y acortamiento conseguido en la SOL.
Se estudiaron otros aspectos adicionales como repercusión de la mejora del sueño en el estado de ánimo.
Resultados: la melatonina logró adelantar el SO en los tres grupos con melatonina; el adelanto en la hora del SO (diferencia con placebo) fue de 42-56 min (p < 0,001).
En cuanto al acortamiento del periodo de SOL (diferencia melatonina vs. placebo): 31-42 minutos (35 minutos cuando la melatonina se administró dos horas antes de la hora deseada para irse a dormir). En cuanto a la diferencia de efecto-dosis: con las tres dosis usadas en el estudio se encontraron reducciones, que fueron siempre significativas (p = 0,007, p = 0,001, y p < 0,001. La DM e IC 95% para cada dosis se muestran en el artículo original en la figura 2a-c.
La interrupción de los tratamientos durante una semana tuvo como resultado la desaparición de las mejoras, con retorno al patrón previo de SO, SOL en hasta el 90% de los pacientes tratados.
Otros hallazgos del estudio: a) la hora a la que se administra la melatonina parece tener una acusada influencia en el tamaño del efecto logrado con el medicamento (adelantamiento del SO). La hora del ciclo circadiano correspondiente al momento de administrar el fármaco (time of administration [TOA]) mostró correlación con el tamaño del adelanto logrado en el SO. Todas las correlaciones entre TOA y efecto fueron negativas, lo cual indica un adelantamiento logrado del SO mayor cuando el fármaco se toma a una hora más temprana. No se encontró una relación clara dosis-respuesta.
Conclusiones de los autores: el tamaño del efecto, adelantando el SO y acortando la latencia del inicio del sueño logrado con el tratamiento con melatonina, aumenta con un TOA más temprano (en relación con el reloj circadiano).
No ocurrieron eventos adversos de consideración durante el periodo corto de tratamiento usado en el estudio.
Financiación/conflicto de intereses: los autores del artículo declaran que la melatonina para la preparación de los preparados farmacéuticos individuales utilizados en la investigación fue proporcionada por Pharma Nord, Dinamarca. El primer autor del metaanálisis (primer artículo seleccionado) y del ECA de este artículo valorado son la misma persona.
COMENTARIO CRÍTICO
Justificación: se han publicado bastantes estudios sobre la eficacia de la melatonina en distintas indicaciones así como para insomnio crónico (de inicio del sueño o de otra clase) en niños y adultos afectos de diferentes tipos de problemas médicos crónicos (trastornos del neurodesarrollo, trastornos psiquiátricos, déficits cognitivos…). Sin embargo, para la indicación concreta de la melatonina para trastornos crónicos de insomnio de inicio del sueño/SRF en pacientes sanos sin problemas médicos crónicos (especialmente en niños), hasta hace poco tiempo no han comenzado a aparecer estudios publicados. Actualmente, parece muy necesario evaluar la eficacia y delimitar el papel terapéutico en pacientes pediátricos, con estos tipos de problemas de sueño, de fármacos para el insomnio distintos a los clásicos. La melatonina aparece con fuerza, demandada incluso por los padres, en las consultas de los pediatras.
Teniendo en cuenta que los resultados encontrados en el metaanálisis, en lo referente a parámetros de sueño, muestran valores muy diferentes para niños y para adultos, y dado que se realizó un análisis por separado de los resultados provenientes de los cuatro ECA pediátricos, estos últimos consideramos que nos aportan la información más útil para responder a nuestra pregunta clínica.
Validez o rigor científico: para el metaanálisis solamente se analizaron aquellos estudios que específicamente informaron de la relación entre la hora de administración de la melatonina y su relación con el reloj interno circadiano. Esto deja la duda de que pudieran haber sido ignorados estudios con información válida (EA y eficacia).
Dos de los cuatro ECA pediátricos del metaanálisis eran investigaciones en pacientes con SOI crónico y TDAH comórbido (uno de ellos fue el ECA que más participantes aportó al análisis combinado). Además de estos dos ECA, en los cuales el 100% de los participantes eran TDAH, en los otros dos ECA pediátricos del metaanálisis3,4 se incluyeron porcentajes altos de participantes diagnosticados de TDAH: alrededor del 27 y el 50%, respectivamente. Todo esto significa que el metaanálisis (en lo que se refiere a sus participantes pediátricos) fue más un estudio de la melatonina en niños y adolescentes con SOI y TDAH, que no un estudio en niños sanos con DSPD/SRF. Hubiera sido más prudente limitar en los criterios de inclusión del metaanálisis ECA sin comorbilidades de ningún tipo (puesto que la mayoría de niños y adolescentes con este tipo de ritmo circadiano, o con SOI en general, son niños sanos y los participantes pediátricos del metaanálisis en absoluto resultan representativos de ese hecho).
Los autores del metaanálisis no ofrecen en el artículo la estrategia de búsqueda empleada ni los descriptores. La restricción por idioma, buscando solo artículos publicados en inglés, y la ausencia de intento de búsqueda para trabajos no publicados constituyen limitaciones claras del artículo.
El total de niños3-6 del metaanálisis fue de 226 pacientes, lo que supone un número total de participantes más bien bajo. También era bajo el número de pacientes del ECA del segundo artículo.
Un ECA4 pediátrico mostró un porcentaje de pérdidas bastante elevado (11,4%).
En el metaanálisis, 3 de los 4 estudios pediátricos fueron realizados por un mismo grupo investigador, y el primer autor de dos de los ECA3,4 fue también uno de los autores del propio metaanálisis. Esto puede traducirse en un sesgo de selección.
Aunque la elección de estudios que usaban parámetros de evaluación directa del sueño, parece adecuada para una investigación inicial de melatonina versus placebo, también creemos que esos parámetros podrían considerarse como resultados subrogados o parciales. Los verdaderos efectos finales importantes, que sería necesario investigar también, deberían ser aquellos que correspondiesen a mejoría en las horas diurnas de vigilia obtenidas al mejorar el sueño (cognición, progreso en el aprendizaje y rendimiento escolar; mejora de la calidad general de vida; atención; comportamiento; desaparición de la somnolencia diurna…). Tres de los ECA pediátricos del metaanálisis incluyeron alguna de estas variable de resultados (Tabla 2). En el metaanálisis, los resultados en esta área ni se extrajeron ni se analizaron.
De los parámetros de sueño estudiados, solo tendremos en cuenta dos de ellos (SO/SOT y la SOL), puesto que solo estos son válidos y útiles para responder nuestra pregunta clínica. El verdadero medidor fiable del efecto es el adelanto en el SOT, del mismo modo que el primer criterio para definir el problema era el retraso en el mismo.
Cointervenciones farmacológicas: en los dos ECA de Smits, que incluyeron un número significativamente elevado de participantes diagnosticados con TDAH, (la gran mayoría de ellos medicados con fármacos estimulantes), hubiera sido necesario haber realizado un análisis por subgrupos.
Especialmente en el ECA de Smits de 20034, la falta de homogeneidad de los grupos arroja todo género de dudas sobre la validez externa de los resultados. Los autores son conscientes de este punto, y dan fe sobre este hecho. La notable diferencia en los porcentajes de participantes con metilfenidato que presentaron los grupos (más del doble en el GP que en el GM), podría haber tenido como consecuencia la alteración de los resultados hacía una dirección muy clara: sobreestimar el efecto de la melatonina. También en el estudio de Smits 20013 llamaba la atención una diferencia importante en el punto cero del estudio: el SOT ocurría, en promedio, a una hora más tardía (en 32 minutos) en el GM que en el GP, lo cual también podría haber alterado los resultados de la comparación.
Algo verdaderamente llamativo en los ECA de niños con TDAH es que las cifras de comorbilidades del TDAH que mostraban los participantes, fueron altísimas. Como consecuencia de esto, las muestras de estos estudios no resultan representativas de la población real de niños con TDAH. No solo queda comprometida la generalizabilidad de los resultados para la población real de niños con retrasos del inicio del sueño, sino que los resultados no son, tampoco, directamente generalizables ni siquiera a pacientes con TDAH y SOI.
En el metaanálisis, las diferentes dosis fueron recogidas, pero no se realizó un análisis separado de su influencia en el efecto.
No hay constancia de que se realizará un estudio de sensibilidad en el metaanálisis y no se ofrece información sobre estudio de homogeneidad.
Importancia clínica: las investigaciones correspondientes a los estudios valorados demuestran, sin dejar dudas, que los resultados son mejores para melatonina que para placebo en insomnio por retraso de fase/inicio retrasado de sueño de adolescentes y de niños en edad escolar. Sin embargo, el relativamente pequeño tamaño del adelanto obtenido en la hora de sueño, deja dudas sobre la significancia clínica de este efecto.
Las evaluaciones de las variables distintas a parámetros de sueño (cognición, estado general de salud, capacidad de atención en horas de vigilia…) no mostraron resultados claramente definidos, aunque, de nuevo, en algunos ECA del metaanálisis, los resultados en estas variables quedan muy comprometidos (sobre todo para su posible generalización) debido al alto número de participantes diagnosticados de TDAH que recibían, además, medicaciones estimulantes.
Los resultados también demuestran que el efecto de la melatonina, en términos de mejoría en los parámetros de sueño, desaparece después de finalizar periodos de tratamientos de corta duración (1-4 semanas).
Parece quedar también demostrada la ausencia de EA de consideración, y los leves EA comunicados mantuvieron cifras de incidencia aceptables. De todas formas, este buen perfil de seguridad solamente está establecido para periodos de duración corta (< 1 mes) y son datos procedentes de pocos estudios con muestras pequeñas. Y, nuevamente, en los estudios con niños que presentaban TDAH (con muy altos índices de comorbilidades y de tratamientos con fármacos estimulantes) la delimitación de reacciones y efectos adversos debidos a la melatonina se ve claramente muy dificultada.
Tamaño del efecto y su importancia clínica: la pregunta con verdadero interés clínico sería ¿los tamaños de los efectos encontrados en estos estudios son lo suficientemente buenos como para solucionarle a estos niños el problema del retraso en el inicio del sueño? En los 5 ECA estudiados, las medias encontradas estuvieron en los siguientes rangos: 26, 9-63 minutos (adelanto del SO), y 8-42 minutos (reducción en la SOL). Este logro de la melatonina ¿supone un cambio notable en la situación de los niños y adolescentes con DSPD/SOI crónico? Conseguir un adelanto de 30-45 minutos en la hora del SO (15-40 minutos de acortamiento del SOL) ¿supone un aporte importante a lo que está demostrado que ya puede conseguirse con las medidas no farmacológicas usuales para este problema? En los artículos de los ECA analizados, por lo general no se nos proporcionan los datos numéricos para conocer la dimensión de los retrasos reales de los participantes en la hora de SOT (únicamente Weiss, informa en su ECA de una media 91,7 minutos de retraso en la SOL), pero es muy probable que, la mayoría de los niños y adolescentes, por lo demás sanos, que nos consulten por SRF/SOI crónico, presenten retrasos superiores a dos o tres horas en días normales de colegio. Teniendo esto en cuenta, la melatonina parece perfilarse, más bien como una herramienta opcional para estos insomnios, capaz de “aportar algo de ayuda” más que como “la solución”, definitiva, al problema. En realidad, alguno de estos ECA, incluso sirve para poder mostrar, para el caso de las medidas de higiene del sueño, un efecto de mayor tamaño que el de la intervención con melatonina6. Pero todo esto no nos debería llevar a concluir que no hay razón para utilizar la melatonina en niños con este problema, puesto que el tamaño pequeño ¿es razón suficiente para que neguemos esta ayuda a los niños con este problema (sobre todo a los que tiene retraso mayores)? Poco es siempre mejor que nada, y el tamaño del efecto (por ejemplo: 30 minutos de adelanto del SO) puede ser algo estimable para la situación de algún niño concreto.
Aplicabilidad a la práctica clínica: aún son muchos los interrogantes sin resolver sobre la aplicación de melatonina exógena como medicamento para insomnios por retraso de inicio del sueño. Muchas de estas cuestiones no resueltas tienen que ver con los tratamientos prolongados (EA, prolongación del efecto tras el periodo de tratamiento), pero también, para los periodos cortos de tratamiento, para los que si disponemos de estudios y de más datos, hay muchos puntos con dudas no resueltas:
- El efecto beneficioso demostrado para la melatonina no parece permanecer en el tiempo. A la vista de los resultados parece quedar demostrado que el efecto conseguido desaparece cuando se retira el fármaco después de periodos de tratamiento de corta duración (< 1 mes)2. Un estudio posterior (sin control con grupo placebo) encuentra nuevamente este dato7.
- En el metaanálisis se comenta la hipótesis de que la adecuación del momento de administración del fármaco (la hora administración apropiada [TOA]) se relaciona con un mejor efecto logrado por la melatonina, en términos de adelanto del inicio del sueño (aunque no lo evidencian los resultados)2. En el ECA de van Geijlswijk, esta correlación queda incluso demostrada por sus resultados. Como consecuencia de ello, los autores se postulan a favor de una administración más temprana del medicamento. Esta propuesta de administración temprana genera preocupación sobre la posibilidad, no descartada hasta ahora, de aparición de sopor y somnolencia, como efecto indeseado de la melatonina, lo cual podría interferir con la capacidad de concentración adecuada que los niños mayores y adolescentes pueden requerir en las últimas horas de vigilia del día para estudiar y realizar tareas escolares. En los niños diagnosticados con TDAH y tratamientos con metilfenidato, el adelanto propuesto en el TOA podría dar lugar a más solapamiento en el tiempo de la acción de ambos medicamentos.
Otro punto no resuelto es el de si la melatonina consigue lo mismo, en términos de adelanto del SOT, en escolares y adolescentes con retrasos pequeños, que en aquellos con retrasos mucho mayores. Dar respuesta a este interrogante tendría consecuencias clínica decisivas, puesto que lo que realmente necesitamos saber los pediatras clínicos es qué resultado sería esperable en el subgrupo de pacientes que presenta retrasos más marcados (que son los que de verdad tienen el problema, y que son los que probablemente acudan a nuestras consultas preguntando por medicamentos para el insomnio). En los ECA pediátricos aquí valorados el punto de corte en los criterios de inclusión se sitúo bastante bajo (a partir de 30 minutos de retraso del SOT). Cabe preguntarse, en aquellos que ya lograron con estrategias no farmacológicas correctas, dejar reducido su retraso del inicio del sueño a solo media hora: ¿tienen un problema estos pacientes merecedor de tratar con fármacos? En futuros ECA será imprescindible investigar en aquellos niños, sanos por lo demás, pero con retrasos marcados en el SOT (lo que se podría conseguir elevando el umbral en los criterios de admisión, o realizando luego análisis de subgrupos).
En la literatura publicada encontramos datos sobre estimaciones de la prevalencia de niños (< 6 años) y adolescentes, con dificultad para dormirse a las horas esperadas, tan elevadas como del 27%. Se informa de frecuencias de SOL > 30 minutos en al menos un 11%8. Otros autores comunican cifras estimadas alrededor de 7-10% de SRF en adolescentes9. La relativa falta de cifras, y las diferencias entre estimaciones en la literatura, puede que reflejen el solapamiento y mezcla de problemas y definiciones diferentes (SOI crónico; retraso de fase fisiológico del adolescente; verdaderas alteraciones cronobiológica del ritmo circadiano de la melatonina correspondiente al SRF; consecuencias de la privación prolongada por normas sociales impuestas…).
Son necesarios nuevos ECA en niños sanos, bien diseñados y bien realizados, sin ninguna medicación correspondiente a tratamientos crónicos que puedan afectar al sueño, con tamaños muestrales mayores, con duración más prolongada, capaces de delimitar el resultado de la melatonina en el subgrupo de pacientes con retraso de inicio del sueño más prolongados, y con variables de resultados que investiguen sobre la influencia de la mejoría del sueño en las horas de actividad diurna (estado general de salud, estado de ánimo, aprendizaje, etc.).
Los resultados de estos estudios respaldan la posibilidad de usar la melatonina exógena, como herramienta terapéutica complementaria de utilidad junto a otras medidas, en escolares y adolescentes con SOI/SRF crónicos. Su uso puede plantearse en determinados casos, siempre que se cumpla que, para el paciente concreto que estemos considerando, se acepte un tratamiento no superior a un mes, y siempre que no se haya logrado un resultado suficientemente favorable después de aplicar de forma correcta, las medidas no farmacológicas eficaces. Hay que informar del relativamente pequeño efecto demostrado, en base a las pruebas disponibles. El uso generalizado y masivo de la melatonina exógena (teniendo en cuenta que la melatonina es una hormona con efectos multiorgánicos), no estaría justificado y nos parece que, por este motivo sería aconsejable mantener la clasificación de este fármaco como de dispensación obligatoria con receta médica. Los tratamientos con melatonina exógena deberían mantenerse bajo estricto control, y supervisión médica, del pediatra de atención primaria o del médico experto en sueño.
RESOLUCIÓN DEL ESCENARIO
Lo primero que le aconsejaremos es usar todas las medidas no farmacológicas que podrían ayudar: a) evitar la exposición lumínica antes de acostarse (luces fuertes, ordenador, aparato de televisión, teléfonos móviles, videoconsolas, etc.); b) evitar ejercicio físico en las últimas horas de la tarde; c) técnicas de relajación antes de dormir; d) eliminar alguna activad extracurricular prescindible (agenda sobrecargada), y e) evitar en la tarde y noche la ingesta de bebidas que contengan cafeína. El baloncesto y las clases particulares finalizarán dentro de una semana (final de curso). En el próximo curso están de acuerdo en reducir las actividades extracurriculares (siempre antes de las 19:00 h). Un colegio más cercano, o con un inicio de actividades escolares no tan temprano, modificaría la situación, pero quieren ese colegio.
Se informa del tamaño del beneficio que puede aportar la melatonina, de los puntos aún no aclarados y de que actualmente no está disponible en España como fármaco bajo prescripción con receta. Los padres creen que puede interesarles añadir un ciclo de 1 mes con melatonina a las medidas recomendadas, si después del periodo de prueba aún el niño no se duerme antes de las 11:30 (un mes de tratamiento es suficiente para ellos durante exámenes finales, aunque luego se restablezca la situación previa) y 30 minutos de adelanto del inicio del sueño puede suponer un incremento del 10% en el tiempo total de sueño. Se acuerdan seguimientos y controles.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflicto de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: AIT: análisis por intención de tratar • CA: resultados de la combinación de los ECA con pacientes adultos • CE: criterios de exclusión • CI: criterios de inclusión • CP: resultados de la combinación de los ECA pediátricos • DLMO: comienzo del aumento de la melatonina con la atenuación vespertina de la luz (dim light melatonin onset) • DM: diferencia de medias • DSPD/SRF: trastorno del sueño por retraso de fase (delayed sleep phase disorder) • EA: efectos adversos • ECA: ensayos clínicos aleatorizados, con cegamiento doble y controlados con placebo (P: diseño paralelo/X: diseño cruzado) • GM: grupo de tratamiento con melatonina • GP: grupo placebo • IC 95%: intervalo de confianza del 95% • N: tamaño de la muestra • NNT: número necesario para tratar • NS: no significativo • RAND-GHRI: ecala de valoración del estado general de salud (rating scale for the assessment of the general health status) • SO: inicio del sueño (sleep onset) • SOI: insomnio de inicio del sueño (sleep onset insomnia) • SOL: latencia del inicio del sueño (sleep onset latency) • SOT: hora de inicio del sueño (sleep onset time) • TC: resultados con el promedio global de los nueve ECA del metaanálisis • TDAH: trastorno por déficit de atención e hiperactividad • TOA: hora de administración apropiada • TTS: tiempo total se sueño • WUT: hora de despertarse por la mañana (wake-up time).
BIBLIOGRAFÍA
- van Geijlswijk IM, Korzilius HPLM, Smits MG. The use of exogenous melatonin in delayed sleep phase disorder: a meta-analysis. SLEEP. 2010;33:1605-14.
- van Geijlswijk IM, van der Heijden KB, Egberts AC, Korzilius HP, Smits MG. Dose finding of melatonin for chronic idiopathic childhood sleep onset insomnia: an RCT. Psychopharmacology (Berl). 2010;212:379-91.
- Smits MG, Nagtegaal EE, van der Heijden J, Coenen AM, Kerkhof GA. Melatonin for chronic sleep onset insomnia in children: a randomized placebo-controlled trial. J Child Neurol. 2001;16:86-92.
- Smits MG, van Stel HK, van der Heijden K, Meijer AM, Coenen AM, Kerkhof GA. Melatonin improves health status and sleep in children with idiopathic chronic sleep-onset insomnia: a randomized placebo-controlled trial. J Am Acad Child Adolesc Psychiatry. 2003;42:1286-93.
- van der Heijden KB, Smits MG, Van Someren EJ, Ridderinkhof KR, Gunning WB. Effect of melatonin on sleep, behavior, and cognition in ADHD and chronic sleep-onset insomnia. J Am Acad Child Adolesc Psychiatry. 2007;46:233-41.
- Weiss MD, Wasdell MB, Bomben MM, Rea KJ, Freeman RD. Sleep hygiene and melatonin treatment for children and adolescents with ADHD and initial insomnia. J Am Acad Child Adolesc Psychiatry. 2006;45:512-9.
- van Maanen A, Meijer AM, Smits MG, Oort FJ. Termination of short term melatonin treatment in children with delayed Dim Light Melatonin Onset: effects on sleep, health, behavior problems, and parenting stress. Sleep Med. 2011;12:875-9.
- Pin Arboledas G, Cubel Alarcón M, Martin González G, Lluch Roselló A, Morell Salort M. Hábitos y problemas con el sueño de los 6 a los 14 años en la Comunidad Valenciana. Opinión de los propios niños. An Pediatr (Barc). 2011;74:103-15.
- Moore M, Allison D, Rosen CL. A review of pediatric nonrespiratory sleep disorders. Chest. 2006;130:1252-62.
- Sánchez-Barceló EJ, Mediavilla MD, Reiter RJ. Clinical uses of melatonin in pediatrics. Int J Pediatr. 2011;2011:892624.
Comentarios
Este artículo aún no tiene comentarios.





