Cribado de alteraciones visuales (parte 1)
Jaime García Aguadoa, M.ª Jesús Esparza Olcinaa, José Galbe Sánchez-Venturab, Ana Martínez Rubioc, José M.ª Mengual Gild, Manuel Merino Moínae, Carmen Rosa Pallás Alonsof, Francisco Javier Sánchez Ruiz-Cabellog, Julia Colomer Revueltah, Olga Cortés Ricoi, Javier Soriano Fauraj, Grupo PrevInfad/PAPPS Infancia y Adolescenciak
aPediatra. Madrid. España.
bPediatra. CS Torrero La Paz. Zaragoza. España.
cPediatra. CS de Camas. Sevilla. España.
dPediatra. CS Delicias Sur. Zaragoza. España.
ePediatra. CS El Greco. Getafe. Madrid. España.
fServicio de Neonatología. Hospital Universitario 12 de Octubre. Madrid. España.
gPediatra. CS Zaidín Sur. Granada. España.
hDepartamento de Pediatría, Obstetricia y Ginecología. Unidad de Pediatría. Universidad de Valencia. Valencia. España.
iPediatra. CS Canillejas. Madrid. España.
jPediatra. CS Fuensanta. Valencia. España.
kJosé María Mengual Gil (coord.).
Correspondencia: J García. Correo electrónico: jgaguados@gmail.com
Cómo citar este artículo: García Aguado J, Esparza Olcina MJ, Galbe Sánchez-Ventura J, Martínez Rubio A, Mengual Gil JM, Merino Moína M, et al. Cribado de alteraciones visuales (parte 1). Rev Pediatr Aten Primaria. 2014;16:e173-e194.
Publicado en Internet: 24-12-2014 - Número de visitas: 26068
Resumen
En el presente trabajo se revisan y actualizan las recomendaciones de PrevInfad sobre el cribado de alteraciones visuales en la infancia. Se analizan los beneficios en salud de la detección precoz, la validez y seguridad de las pruebas de cribado, la efectividad del tratamiento y los posibles riesgos de la detección precoz y el tratamiento de los problemas detectados.
PrevInfad recomienda incluir la inspección ocular y la prueba del reflejo rojo en las visitas de salud de los primeros seis meses de vida, así como la detección de alteraciones visuales (ambliopía, estrabismo y errores de refracción) a la edad de 3-5 años. La evidencia para evaluar el balance entre los beneficios y los riesgos del cribado de la disminución de la agudeza visual por errores de refracción en niños de 6 a 14 años es insuficiente.
Debido a su extensión, el texto se ha divido en dos partes. Presentamos en este artículo la primera de ellas.
Palabras clave
● Agudeza visual ● Alteraciones visuales ● Ambliopía ● CribadoNota:
Leer texto completo en www.pap.es.
Cómo citar este artículo: García Aguado J, Esparza Olcina MJ, Galbe Sánchez-Ventura J, Martínez Rubio A, Mengual Gile JM, et al. Cribado de alteraciones visuales (parte 1). Rev Pediatr Aten Primaria. 2014;16:xx-xx.
INTRODUCCIÓN
El cribado de las alteraciones visuales tiene importancia para detectar precozmente aquellos trastornos que distorsionan o suprimen la imagen visual normal y pueden causar problemas en el desarrollo de la visión, en el rendimiento escolar o, a veces, como en el caso del retinoblastoma, suponer un riesgo vital. Los programas de cribado visual están muy extendidos en los países desarrollados, aunque su contenido es heterogéneo en cuanto a las pruebas que se aplican, los criterios de derivación o la edad a la que se realizan1.
En el recién nacido y el lactante, el cribado busca la detección precoz de problemas oculares graves aunque infrecuentes, como la catarata congénita o el retinoblastoma. En la edad preescolar tiene como objetivo la detección de la ambliopía y determinados trastornos que suponen un factor de riesgo para desarrollarla. En la edad escolar, el cribado se basa en la detección de la disminución de la agudeza visual por errores de refracción.
El presente documento es una síntesis de distintas revisiones sistemáticas realizadas en los últimos años y que se detallan a continuación:
- Informe técnico sobre la efectividad y el coste-efectividad de los programas de cribado visual publicado en 2008 por el Health Technology Assessment (HTA) Programme del Reino Unido2.
- Revisión Cochrane sobre el cribado de la ambliopía, publicada en 20093.
- Revisión Cochrane sobre el cribado de los errores de refracción en escolares y adolescentes, publicada en 2004 y actualizada en 20094.
- Revisión sistemática sobre la efectividad del cribado visual en niños de 0 a 16 años elaborada en 2009 para la Commonwealth of Australia por el Centre for Community Child Health del Murdoch Childrens Institute5.
- Revisión sistemática sobre el cribado de alteraciones visuales en niños de uno a cinco años para actualizar la recomendación de 2004 del U.S. Preventive Services Task Force (USPSTF), publicada en 20116.
- Revisión sistemática sobre el cribado de alteraciones visuales en niños de cuatro a cinco años para actualizar las recomendaciones del National Screening Committee del Reino Unido (UK NSC), publicada en 20137. Se basa en un informe previo de 1997 que analizó los datos publicados hasta 19958, por lo que solo se revisaron los estudios publicados desde 1995 a julio de 2012.
- Informe técnico sobre el coste-efectividad de la detección precoz de problemas de visión en la edad pediátrica, elaborado para el Ministerio de Sanidad, Servicios Sociales e Igualdad por el Instituto Aragonés de Ciencias de la Salud, en el que se analizó la bibliografía publicada hasta abril de 201310.
GLOSARIO DE TÉRMINOS
Acomodación: ajuste del foco del ojo para enfocar en la retina las imágenes situadas a una distancia variable. Depende del poder de refracción del cristalino, que cambia variando su forma.
Agudeza visual (AV): capacidad del ojo para distinguir como separados dos puntos u objetos próximos entre sí.
Ambliopía: agudeza visual reducida en ausencia de enfermedad orgánica, que no mejora con el uso de lentes.
Ametropía: incapacidad del ojo para enfocar un objeto en la retina.
Anisometropía: diferencia refractiva entre ambos ojos.
Astenopía: cansancio o fatiga ocular que puede deberse a errores de refracción no corregidos y se manifiesta por síntomas como cefalea, dolor ocular, visión borrosa, parpadeo o diplopia.
Astigmatismo: error de refracción causado por irregularidades en la córnea o el cristalino y caracterizado porque cada meridiano del ojo tiene una refracción diferente.
Autorrefracción: medida objetiva del estado de refracción mediante un dispositivo computarizado.
Catarata: opacidad del cristalino o de su cápsula.
Cilindro: medida de la intensidad del astigmatismo expresada en dioptrías.
Dioptría: unidad de medida de la potencia de una lente. Es el valor inverso de la distancia focal expresada en metros. En las lentes convergentes las dioptrías tienen valor positivo y en las divergentes el valor es negativo.
Emetropía: estado normal del ojo en el que la imagen se enfoca en la retina sin necesidad de acomodación.
Error de refracción: ametropía.
Escala logMAR: escala usada para medir la agudeza visual (logaritmo del ángulo mínimo de resolución).
Esfera: medida del grado de miopía o hipermetropía expresada en dioptrías. Un valor negativo indica miopía y un valor positivo indica hipermetropía.
Esoforia: forma de estrabismo latente en la que un ojo se desvía hacia dentro cuando se suprime la fusión.
Esotropía: forma de estrabismo manifiesto en la que un ojo se desvía hacia dentro.
Estereopsis: percepción en profundidad o tridimensional.
Estrabismo latente: tendencia de uno o ambos ojos a desviarse cuando se suprime la fusión binocular.
Estrabismo manifiesto: desviación del eje visual de un ojo del punto de fijación. Puede ser constante o intermitente.
Estrabismo: pérdida de la alineación de los ejes visuales. Puede ser latente o manifiesto.
Exoforia: forma de estrabismo latente en la que un ojo se desvía hacia fuera cuando se suprime la fusión.
Exotropía: forma de estrabismo manifiesto en la en que un ojo se desvía hacia fuera.
Fármaco ciclopléjico: droga que bloquea el músculo ciliar, impidiendo la acomodación. También induce una dilatación pupilar.
Foria: desviación de los ojos cuando se suprime la fusión.
Fotocribado: técnica objetiva de cribado de los factores de riesgo ambliogénico que evalúa el reflejo pupilar y el reflejo rojo en una imagen fotográfica digitalizada.
Heteroforia: estrabismo latente.
Heterotropía: estrabismo.
Hipermetropía: error de refracción en el que la imagen se enfoca por detrás de la retina. Puede corregirse con una lente convexa.
Hiperopia: hipermetropía.
Leucocoria: reflejo o mancha blanca en la pupila.
Miopía: error de refracción en el que la imagen se enfoca por delante de la retina. Puede corregirse con lentes cóncavas.
Oclusión: procedimiento para impedir la visión de un ojo, total o parcialmente, con el objetivo de evitar o reducir la estimulación visual.
Ortoforia: situación ideal en la que los ejes visuales permanecen alineados con el objeto de fijación, que no se altera con la ruptura de la fusión.
Prueba de Bruckner: reflejo rojo valorado de forma simultánea en ambos ojos.
Prueba de Hirschberg: prueba para detectar el estrabismo que consiste en la observación del reflejo luminoso corneal cuando se proyecta una luz sobre la cara. En situación de ortoforia el reflejo debe ser simétrico.
Prueba de tapar-destapar: prueba para detectar el estrabismo, en la que cada ojo se tapa alternativamente mientras el niño tiene la mirada fija en un objeto y el explorador observa los movimientos de los ojos. Existe una foria cuando el ojo varía de posición.
Reflejo rojo: prueba basada en la trasmisión de la luz del oftalmoscopio a través de los medios transparentes del ojo. Cualquier factor que impida o bloquee el paso de la luz causará una alteración en el reflejo rojo.
Retinoblastoma: tumor maligno de crecimiento rápido originado en las células neuroepiteliales de la retina.
Snellen: escala usada para medir la agudeza visual. En la actualidad ha sido reemplazada por la escala logMAR.
DESARROLLO VISUAL
El sistema óptico constituido por la retina, el nervio óptico y la corteza cerebral es muy inmaduro al nacimiento. La función visual madura en los primeros años de vida como consecuencia del desarrollo estructural y funcional de los ojos y las vías visuales nerviosas. El recién nacido tiene una agudeza visual inferior a 1,0 logMAR (o 6/60 Snellen), que madura hasta un promedio de 0,3 logMAR (6/12 Snellen) hacia los 24 meses y se aproxima al nivel del adulto a los cinco o seis años10-12. El sistema visual alcanza la maduración casi completa en los primeros tres años de vida, aunque persiste una cierta plasticidad entre los tres y los ocho años.
Los estímulos visuales tienen una importancia crítica en el desarrollo de la visión. Para que las vías visuales del sistema nervioso central se desarrollen adecuadamente, es imprescindible que el cerebro reciba imágenes nítidas y enfocadas de ambos ojos de forma simultánea. Cualquier anomalía que distorsione o suprima la imagen visual durante el periodo sensible del desarrollo visual puede dar lugar a una ambliopía. Los principales factores de riesgo para el desarrollo de la ambliopía son la falta de alineamiento visual (estrabismo), una visión desigual entre los dos ojos (anisometropía) o una visión borrosa en ambos ojos (error de refracción bilateral). Una vez que se ha completado la maduración visual, a partir de los 6-8 años, desaparece el riesgo de desarrollo de ambliopía13. Asimismo, el tratamiento de la ambliopía será menos eficaz o incluso ineficaz si se inicia tardíamente, una vez completado el desarrollo visual.
La posición frontal de los ojos hace que las imágenes de ambos ojos se superpongan en gran medida, aunque no llegan a ser completamente iguales. La convergencia en la corteza cerebral de la imagen que recibe cada ojo en una única imagen se denomina fusión binocular y permite la visión en profundidad. La visión binocular o estereopsis se desarrolla entre los tres y seis meses de vida y precisa un desarrollo normal de la visión en cada ojo y una alineación correcta de ambos ojos.
La mayoría de los recién nacidos tienen errores de refracción al nacimiento, principalmente hipermetropía, aunque algunos tienen grados leves de miopía. A lo largo de la infancia, y principalmente en el primer año de vida, se produce un rápido proceso de emetropización, de forma que al inicio de la escolarización la mayoría de los niños son emétropes14.
CRIBADO DE ALTERACIONES VISUALES EN RECIÉN NACIDOS Y LACTANTES
La búsqueda en el periodo neonatal de opacidades de los medios transparentes causadas por trastornos como la catarata congénita o el retinoblastoma está ampliamente aceptada, aunque no ha sido evaluada formalmente. No hay evidencia sobre la efectividad de un programa de cribado de la catarata congénita o el retinoblastoma y no es previsible, por razones éticas, que se haga un ensayo clínico en el que se aleatorice a los niños en un grupo al que se le haga la prueba del reflejo rojo frente a otro al que no se le realice.
La catarata congénita tiene una tasa de prevalencia de 2-3 casos por 10 000 nacidos vivos15,16 y la incidencia de retinoblastoma es de un caso por 15 000-20 000 nacidos vivos17,18. Aunque son trastornos poco frecuentes, su impacto en cuanto a pérdida de visión puede ser muy alto.
La exploración ocular con oftalmoscopio para ver el reflejo rojo permite detectar una catarata congénita o un retinoblastoma19. Es una prueba simple y segura, aunque precisa de un entrenamiento especifico y no siempre es fácil de hacer en los primeros días de vida. No disponemos de datos sobre su validez o su efectividad como prueba de cribado. Tampoco se ha determinado la edad óptima para su realización ni la necesidad de repetirla en los primeros meses de vida.
En un estudio de base poblacional realizado en el Reino Unido, el 47% de los casos de catarata congénita fueron detectados en la exploración realizada en los exámenes de salud realizados en el recién nacido o a las 6-8 semanas de vida, frente al 29% que fueron diagnosticados después de los 12 meses de vida20. Otro estudio descriptivo realizado en los EE. UU., en el que se analizaron los casos de catarata congénita detectados durante 30 años en el área metropolitana de Atlanta, mostró que el 38% de los casos fue diagnosticado después de las seis semanas de vida21. La prueba del reflejo rojo no se ha estudiado de forma prospectiva, por lo que no es posible saber si las bajas tasas de detección descritas en el periodo neonatal se deben a una baja cumplimentación, a una técnica inadecuada o a una baja sensibilidad de la prueba como herramienta de cribado.
En Suecia, donde se realiza el cribado de forma habitual en el 90% de las maternidades, el 75% de los casos de cataratas congénitas corregidas quirúrgicamente en el primer año de vida se detectan antes de las seis semanas de edad, una cifra significativamente superior respecto a los datos históricos de las regiones del país donde no se realizaba el cribado en las maternidades, en las que la tasa de detección en las primeras 6 semanas era del 38%22.Tras instaurar la exploración del reflejo rojo en una unidad de neonatología de Israel y realizarla a 11 500 recién nacidos durante dos años, se produjeron 12 derivaciones y se diagnosticaron cinco casos de catarata congénita, con una especificidad del 42%23.
El reflejo rojo tiene una baja sensibilidad para la detección del retinoblastoma24. Algunos estudios sugieren que la leucocoria o el estrabismo como manifestaciones de un retinoblastoma son detectados por la familia más frecuentemente que por el pediatra de Atención Primaria. En un análisis retrospectivo de 1632 casos en niños que no tenían antecedentes familiares de retinoblastoma, el 80% fueron detectados por la familia y el 8% por el pediatra25 y, en otro estudio retrospectivo de 57 casos, el 75% fueron detectados por la familia y el 5% por el pediatra26. Aunque una prueba de cribado debe tener idealmente una sensibilidad alta, en el caso del retinoblastoma, al tratarse de una enfermedad potencialmente letal, es aceptable la baja sensibilidad de la prueba.
El diagnóstico y tratamiento precoz de la catarata congénita es esencial para obtener mejores resultados en cuanto a la preservación de la visión27. El retraso en el tratamiento puede causar una ambliopía irreversible por privación del estímulo visual y la consecuente pérdida de la visión en el ojo afectado. Para obtener un resultado óptimo que evite la pérdida visual, la cirugía de la catarata debe ser realizada en los primeros tres meses de vida y, posiblemente, mejor en las primeras 6-8 semanas28,29.
El retinoblastoma permanece intraocular y curable durante un periodo de 3-6 meses desde el primer signo de leucocoria17. La detección precoz aumenta las posibilidades de supervivencia. Con un diagnóstico precoz y el tratamiento adecuado, la tasa de curación es del 98%, en muchos casos preservando la visión30.
Un estudio económico encontró que, en Suecia, el cribado de las cataratas realizado de forma combinada en las maternidades y en los controles de salud del lactante es coste-efectivo comparado con el cribado realizado solo en el lactante después del alta hospitalaria31. No se han encontrado otras evaluaciones económicas sobre el cribado de problemas oculares a esta edad ni estudios sobre los riesgos potenciales del cribado.
CRIBADO DE ALTERACIONES VISUALES EN NIÑOS DE UNO A CINCO AÑOS
La deficiencia visual derivada de la ambliopía o los factores de riesgo ambliogénico puede disminuir la calidad de vida y el rendimiento académico. Además, la ambliopía que surge durante el periodo crítico del desarrollo visual puede dar lugar a una pérdida definitiva e irrecuperable de la visión unilateral y de la estereopsis.
El tratamiento de los factores de riesgo ambliogénico tiene como objetivo la disminución del riesgo de desarrollar ambliopía. El diagnóstico de la ambliopía en la edad preescolar permite iniciar el tratamiento en edades tempranas, cuando es más eficaz para mejorar o incluso normalizar la agudeza visual en el ojo ambliope. La corrección de los errores de refracción en esta edad, antes de la etapa escolar, podría, potencialmente, mejorar el rendimiento académico.
Las pruebas de cribado son poco invasivas y relativamente fáciles de hacer. Aunque hay escasa evidencia sobre su aceptabilidad, se puede asumir de forma razonable que son aceptables para los niños y sus familias7.
DEFINICIONES
La ambliopía es una disminución unilateral o, muy rara vez, bilateral, de la agudeza visual, que surge durante el periodo del desarrollo visual y no puede ser atribuida a una alteración estructural del ojo o de las vías visuales. Habitualmente se asocia a una ausencia o disminución de la estereopsis. Su origen radica en un procesamiento anormal de las imágenes visuales por el cerebro durante el periodo del desarrollo visual, que da lugar a una disminución funcional de la agudeza visual.
La definición más aceptada de la ambliopía es una diferencia de dos o más líneas de agudeza visual entre ambos ojos32. Cuando se utiliza la agudeza visual monocular, el punto de corte para la definición de la ambliopía oscila entre 0,2 y 0,4 logMAR (aproximadamente 6/9 y 6/15 Snellen respectivamente), lo que refleja la dificultad de establecer con certeza un nivel de visión que tenga repercusión clínica significativa7.
La ambliopía es un diagnóstico de exclusión. Se asocia a trastornos que interfieren con la visión binocular, como el estrabismo, la anisometropía o los errores de refracción bilaterales y significativos. Más raramente puede ser debida a la privación de estímulo por opacidad de los medios transparentes (córnea, humor acuoso, cristalino y humor vítreo) u otras situaciones que bloquean la vía visual, como la ptosis. Otros factores de riesgo para el desarrollo de ambliopía son la prematuridad, el bajo peso al nacer y los antecedentes familiares. Los principales factores de riesgo ambliogénico están reflejados en la Tabla 133.
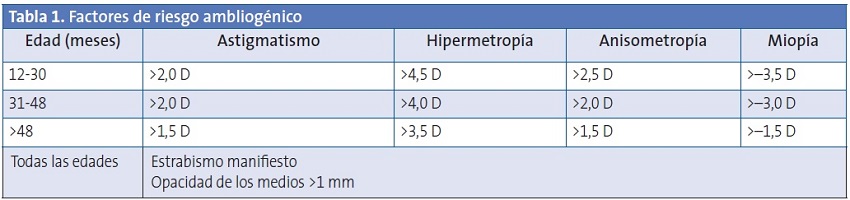
D: dioptría.
Modificada de Donahue SP et al.33.
Si no se trata, la ambliopía puede llegar a ser irreversible. El tratamiento consiste en la corrección de los factores de riesgo ambliogénico en primer lugar y, si persiste la ambliopía, el siguiente paso se basa en la disminución del efecto supresor del ojo no ambliope mediante el uso de parches o la administración de atropina, que produce una visión borrosa al impedir la acomodación. No está aclarada cuál es la edad óptima para iniciar el tratamiento ni la intensidad o la duración más adecuada del mismo.
El estrabismo es la falta de alineación de los dos ojos. Si aparece durante el periodo del desarrollo visual se suprimirá la imagen cortical para evitar la diplopía, lo que puede dar lugar a una ambliopía o una falta de visión binocular. Es la causa más frecuente de ambliopía. Los errores de refracción incluyen la miopía, la hipermetropía y el astigmatismo, todos ellos corregibles con el uso de lentes. La prematuridad y los antecedentes familiares son factores de riesgo para los errores de refracción.
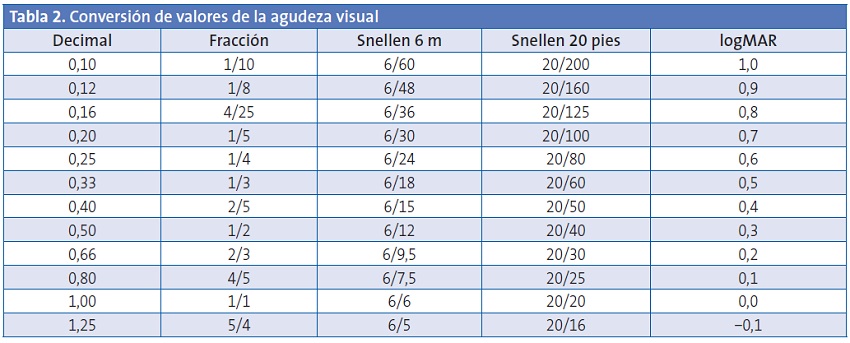
La agudeza visual es la capacidad del ojo para distinguir como separados dos puntos u objetos próximos entre sí. Se mide generalmente utilizando letras u otras formas geométricas. Las dos escalas más utilizadas son la Snellen y la logMAR (Tabla 2).
MAGNITUD DEL PROBLEMA
La ambliopía es un trastorno frecuente en la infancia, aunque las cifras de prevalencia pueden variar en función del umbral usado para definirla en los estudios que analizan esta variable. Hay cierta evidencia de que existen diferencias étnicas en la prevalencia de estrabismo, la ambliopía y los errores de refracción34.
Diversos estudios poblacionales han encontrado una prevalencia de ambliopía de entre el 1 y el 5% aproximadamente en niños menores de seis años, y una prevalencia de estrabismo que oscila entre el 1 y el 3% en edades de 6 a 72 meses35-38. En un estudio realizado en Valladolid en 1997 la prevalencia de ambliopía fue del 7,5%39. Aunque habitualmente se considera como un trastorno propio de la infancia, la ambliopía es la causa más frecuente de pérdida visual monocular en adultos de 20 a 70 años. La prevalencia de los errores de refracción es más elevada, oscilando entre el 15% y 20%40-42, lo que indica que la mayoría de los niños con factores de riesgo no desarrollará una ambliopía, tal como se ha confirmado en un estudio longitudinal de niños identificados mediante cribado visual43.
La visión reducida en un ojo puede afectar a un individuo de diversas formas. Los pacientes con ambliopía tienen mayor riesgo de ceguera por afectación del ojo no ambliope44. En un estudio de base poblacional, el riesgo de pérdida de la visión a lo largo de la vida en individuos ambliopes fue del 1,2% (IC 95: 1,1-1,4)45. En otro estudio de base poblacional, con 5220 adultos de los que 192 tenían ambliopía, el riesgo relativo de pérdida de la visión en individuos ambliopes fue de 2,6 (IC 95: 1,4-4,5)46.
La ambliopía también podría, en teoría, tener impacto en la educación, en el empleo o en otros aspectos sociales, si bien los datos sobre el impacto funcional de la ambliopía son escasos. En un estudio de base poblacional en el que participaron 3654 adultos de 49 o más años, la ambliopía no afectó a la clase ocupacional a lo largo de la vida (p=0,5), aunque menos personas con ambliopía completaron los estudios universitarios (p=0,05)47. Otro estudio, también de base poblacional, no encontró diferencias clínicas o funcionales en individuos con o sin ambliopía en cuanto al nivel educativo alcanzado, el tipo de ocupación, la participación en actividades sociales o la presencia de problemas conductuales, aunque el riesgo de accidentes de tráfico fue mayor entre los 17 y 33 años en individuos con ambliopía moderada o intensa48. En un reciente estudio longitudinal prospectivo de una cohorte de recién nacidos, la ambliopía no tuvo impacto funcional en el desarrollo motor en la infancia, en la autoestima del adolescente ni en nivel socioeconómico en la edad adulta49. Una revisión sistemática sobre el impacto de la ambliopía en la calidad de vida concluyó que está más relacionado con el tratamiento que con el trastorno en sí mismo50.
La ambliopía y el estrabismo, incluso en ausencia de ambliopía, pueden impedir el desarrollo de la visión binocular y la percepción tridimensional. Aunque se sabe que la falta de estereopsis influye negativamente en las habilidades motoras finas51, no está claro cuál es el impacto funcional de la ausencia de visión estereoscópica en individuos que crecen y viven con ambliopía. El estrabismo puede generar problemas psicosociales al ser motivo de burla.
En conclusión, según los datos disponibles el principal impacto de la ambliopía en términos poblacionales radica en su importancia como factor de riesgo de desarrollar ceguera por pérdida de la visión en el ojo no ambliope.
Historia natural
Hay pocos estudios sobre la historia natural de la ambliopía y es altamente improbable que se realice un ensayo clínico con niños aleatorizados para no recibir tratamiento. La pérdida de visión producida por la ambliopía no es reversible de forma inmediata corrigiendo el error de refracción subyacente. Una revisión sistemática de 1997 no encontró estudios bien diseñados que permitieran documentar la historia natural de la ambliopía, el estrabismo o los errores de refracción8. Algunos estudios publicados posteriormente sugieren que la intervención y tratamiento tempranos disminuyen la prevalencia de la ambliopía52,53 y parece poco probable que la ambliopía no tratada revierta espontáneamente54. En un estudio con 18 niños de cuatro a seis años no tratados por falta de cumplimiento terapéutico, todos permanecieron ambliopes un año después del diagnóstico; uno, que utilizó lentes de forma esporádica, tenía mejor visión, siete tenían peor visión en el ojo ambliope y en los diez restantes la ambliopía se mantuvo sin cambios55.
Tradicionalmente se ha considerado que la ambliopía es irreversible si no se trata antes de los 6-10 años. Sin embargo, algunos estudios recientes han encontrado que el tratamiento puede ser eficaz en edades posteriores56,57, aunque la respuesta es inferior a partir de los siete años58. También se ha descrito la mejoría de la agudeza visual en el ojo ambliope en adultos después de perder la visión en el otro ojo45,47. Estos datos indican la existencia de una plasticidad neurológica residual más allá de la ventana clásica de los 8 años.
Preguntas estructuradas
- El cribado visual en niños de uno a cinco años ¿se asocia a mejores resultados de salud?
- ¿Cuál es la validez y seguridad de las pruebas de cribado visual en niños de uno a cinco años?
- ¿Cuál es la efectividad del tratamiento de las alteraciones visuales en niños de uno a cinco años?
- En niños de uno a cinco años ¿influye la edad en la validez y factibilidad de las pruebas de cribado o en la efectividad del tratamiento?
- ¿Cuáles son los riesgos del cribado de las alteraciones visuales en niños de uno a cinco años?
- ¿Cuáles son los riesgos del tratamiento de las alteraciones visuales en niños de uno a cinco años?
- El cribado de las alteraciones visuales en niños de uno a cinco años ¿es coste-efectivo?
El cribado visual en niños de uno a cinco años ¿se asocia a mejores resultados de salud?
Ninguna de las revisiones sistemáticas analizadas ha encontrado ensayos clínicos que evaluaran los resultados del cribado visual comparado con niños a los que no se realiza el cribado en términos de reducción de la prevalencia de ambliopía, mejora del rendimiento académico o de la calidad de vida, por lo que no se conoce la efectividad del cribado visual en preescolares.
Un ensayo clínico aleatorizado de base poblacional, anidado en una cohorte de recién nacidos que formaba parte del proyecto Avon Longitudinal Study of Parents and Children (ALSPAC), comparó el cribado visual realizado por optometristas y repetido seis veces entre los 8 y 37 meses frente a un único cribado realizado a la edad de 37 meses59. El riesgo de tener ambliopía a los 7,5 años fue menor en el grupo de cribado intensivo respecto al de un único cribado (el 0,6% frente al 1,8% respectivamente, p=0,02) y la agudeza visual fue mejor en los niños del grupo de cribado intensivo que en el grupo control (0,15 frente a 0,25 logMAR; p<0,001). La principal limitación de este estudio fue la pérdida del 45% de los niños durante seguimiento. También es destacable que no hubiera diferencias en el análisis por intención de cribar entre los dos grupos: el beneficio del cribado fue indetectable cuando se analizaron todos los niños incluidos en el estudio y no solo aquellos a los que se realizó el cribado (67%).
Un estudio prospectivo de cohortes con la misma población que el estudio anterior no encontró diferencias significativas en el riesgo de ambliopía a los 7,5 años entre realizar un único cribado a los 37 meses por un optometrista o no realizar el cribado53.
Algunos estudios retrospectivos de base poblacional sugieren que el cribado se asocia a una disminución en la prevalencia de ambliopía52,60, pero la baja calidad metodológica limita la fiabilidad de los resultados.
¿Cuál es la validez y seguridad de las pruebas de cribado visual en niños de uno a cinco años?
Existen diversas pruebas de cribado para detectar alteraciones visuales en niños preescolares. La agudeza visual se explora con optotipos. El estrabismo se puede valorar con la prueba de Hirschberg o la prueba de tapar-destapar (cover test). La visión binocular se evalúa con pruebas de estereopsis como el Titmus, el Random Dot E o el TNO; todas ellas se basan en láminas con estereogramas que solo se ven con gafas especiales y siempre que esté establecida la función binocular.
Los métodos automatizados de cribado visual más estudiados son la autorrefracción y el fotocribado. Los autorrefractómetros son sistemas computarizados que permiten valorar de forma objetiva los errores de refracción. El fotocribado es una técnica ampliamente utilizada en algunos países61 que permite detectar los factores de riesgo ambliogénico mediante la evaluación del reflejo pupilar y el reflejo rojo en una imagen fotográfica digitalizada. La mayor utilidad de los métodos automatizados radica en que permiten realizar el cribado visual en niños de uno a tres años62. Para los niños de cuatro o cinco años, ni el fotocribado ni la autorrefracción han demostrado ser superiores o inferiores a la valoración de la agudeza visual mediante optotipos63. Dado el alto coste de su implementación, estos métodos de cribado serían de poca aplicabilidad en nuestro país en el ámbito de la Atención Primaria, por lo que no se analizan en detalle.
La retinoscopia mide la refracción de forma objetiva. Está considerada como la técnica de referencia para la detección de los errores de refracción y debe ser aplicada por especialistas. En niños se realiza bajo cicloplejia para suprimir la acomodación, dado que la mayoría no son capaces de mantener la fijación a distancia durante la prueba.
Los niños a los que no se puede realizar las pruebas de cribado por aparente falta de colaboración tienen mayor frecuencia de alteraciones visuales. En el estudio Vision in Preschoolers Study (VIP), los niños en los que el cribado no fue factible tenían el doble de probabilidades de tener trastornos visuales que los niños que pasaron el cribado64.
En la revisión del USPSTF6 se identificaron 31 estudios sobre la validez de las pruebas de cribado comparadas con un estándar de referencia. Ninguno de ellos fue considerado de buena calidad, 23 eran de calidad débil y cuatro eran de mala calidad. Veintiún estudios evaluaron métodos automatizados como el fotocribado o la autorrefracción. Cuatro estudios de calidad débil evaluaron la agudeza visual con optotipos logMAR65-68. Aunque los autores no encontraron ninguna prueba de cribado asociada de manera consistente a una sensibilidad y especificidad altas (>90%), consideran que la estimación de la validez diagnóstica de las pruebas de cribado sugiere que son de utilidad para identificar a los niños con mayor riesgo de tener trastornos visuales o factores de riesgo ambliogénico.
La revisión de Solebo7 analizó solamente la agudeza visual valorada con la escala logMAR como prueba de cribado y encontró evidencia de la verificabilidad y concordancia de diferentes optotipos en niños menores de seis años.
De todos los estudios publicados, el más amplio es el estudio VIP, un ensayo multicéntrico en el que participaron 2588 niños de tres a cinco años, que comparó la validez de 11 pruebas de cribado diferentes entre las que se incluyen la valoración de la agudeza visual con optotipos Lea y HTOV68,69, la prueba de tapar-destapar y las pruebas de estereopsis Random Dot E y Stereo Smile II. Los resultados anormales del cribado no fueron predefinidos antes de iniciar el estudio sino que, una vez recogidos los datos, se calcularon los puntos de corte para obtener una especificidad de 0,90 o 0,94, lo que podría sobreestimar la validez de las pruebas6. Las diferencias en el cociente de probabilidades y la odds ratio de diagnóstico para las 11 pruebas de cribado fueron generalmente pequeñas, con la excepción de la prueba Random Dot E, que se asoció a una odds ratio diagnóstica inferior.
Agudeza visual
El sistema logMAR es la escala estándar para valorar la agudeza visual y su uso está recomendado por diversos organismos como el International Council of Ophthalmology70, la Organización Mundial de la Salud71 o el Royal College of Ophthalmologists72. Entre los diversos optotipos basados en el sistema logMAR, los más estudiados para el cribado visual en la infancia son los optotipos HTOV, Lea y ETDRS, estos últimos diseñados para adultos y adecuados a partir de los ocho años. Todos los símbolos de los optotipos HTOV y Lea tienen simetría vertical interna (“V” o “H” frente a “B” o “E”, cuya imagen en espejo es distinta), lo que facilita su reconocimiento y puede dar lugar a la obtención de mejores resultados73. Cuando se utiliza el sistema logMAR, la agudeza visual media a los 4-5 años está entre 0,08 y -0,07512,74,75.
Pocos estudios han comparado la validez diagnóstica de los distintos optotipos. En la revisión del USPSTF se identificaron cuatro estudios de calidad débil, como ya hemos señalado. Los autores llegaron a la conclusión de que los optotipos más adecuados en niños menores de cinco años son HTOV y Lea6. Estas pruebas de cribado tienen unos buenos índices de factibilidad en condiciones experimentales, aunque en la mayoría de los estudios se ha valorado su sensibilidad y especificidad para la detección de la ambliopía o los factores de riesgo ambliogénico más que para la detección de la visión reducida en sí misma7.
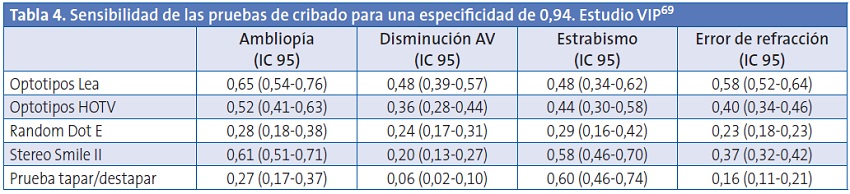
En el estudio VIP, los optotipos HTOV y los Lea tuvieron una validez similar (Tablas 3 y 4). Un resultado anormal en los optotipos Lea aumentó de forma moderada la posibilidad de detectar alguno de los cuatro trastornos buscados (cociente de probabilidades positivo: 6,1; IC 95: 4,8-7,6) y un resultado normal disminuyó débilmente la posibilidad (cociente de probabilidades negativo: 0,42; IC 95: 0,38-0,50) cuando se ajustó el umbral del cribado para alcanzar una especificidad de 0,9068. Los resultados fueron similares cuando los puntos de corte se ajustaron para una especificidad de 0,94 (cociente de probabilidades positivo: 8,2; IC 95: 6,1-11); cociente de probabilidades negativo: 0,54; IC 95: 0,49-0,60)69.
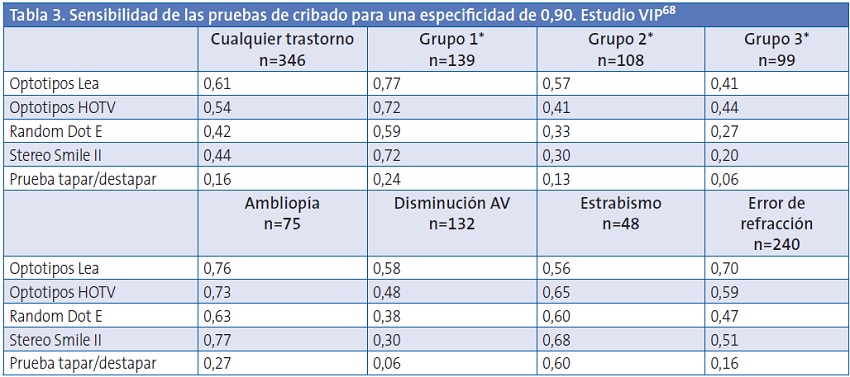
* Los niños fueron clasificados en función de su gravedad:
Grupo 1: niños con trastornos cuya detección y tratamiento precoz es muy importante.
Grupo 2: niños con trastornos cuya detección y tratamiento precoz es importante.
Grupo 3: niños con trastornos cuya detección es menos urgente aunque tiene utilidad clínica.
En otro estudio con 149 niños, los cocientes de probabilidades positivo y negativo de los optotipos Lea para la detección de factores de riesgo ambliogénico fueron de moderados a fuertes según el punto de corte establecido para definir el cribado como anormal. Con el punto de corte en 0,8 logMAR, el cociente de probabilidades positivo fue de 5,7 (IC 95: 3,8-8,6) y el cociente de probabilidades negativo de 0,05 (IC 95: 0,008-0,35), mientras que para un punto de corte de 0,63 logMAR los resultados fueron de 11,7 (IC 95: 5,8-23,7) y 0,23 (IC 95: 0,1-0,5) respectivamente65. Los otros dos estudios evaluados en la revisión del USPSTF fueron realizados con niños nativos norteamericanos y valoraron la validez de los optotipos Lea para la detección del astigmatismo66,67.
El criterio de derivación en los programas de cribado oscila entre 0,2 y 0,3 logMAR (6/9 y 6/12 Snellen)72,76.
Prueba de tapar-destapar
En el estudio ALSPAC la sensibilidad y especificidad de la prueba de tapar-destapar para detectar el estrabismo a los 37 meses fue del 75% (IC 95: 57,7-89,9%) y del 100% respectivamente77. En el estudio VIP (Tabla 3), la sensibilidad de la prueba para detectar el estrabismo, para una especificidad ajustada al 90%, fue del 60%68. No hay más estudios que hayan evaluado la validez de la prueba de tapar-destapar.
Pruebas de estereopsis
En la revisión del USPSTF se analizaron tres estudios de calidad débil que utilizaron la prueba de Random Dot E68,78,79 ; la mediana del cociente de probabilidades positivo fue 4,2 (rango de 3,6 a 11,4) y la mediana del cociente de probabilidades negativo fue 0,65 (rango de 0,15 a 0,81)6.
Un estudio con 58 niños encontró una sensibilidad y una especificidad del 54% y del 87% respectivamente para el Random Dot E80. En otro estudio realizado con 281 niños de 3 a 6 años, la prueba Stereo Butterfly mostró una sensibilidad del 96% y una especificidad del 86% para detectar el estrabismo81. El estudio VIP analizó la factibilidad de tres pruebas de estereopsis (Random Dot E, Stereo Smile y Randot Preschool) en 118 niños de entre 3 y 3,5 años82. El mejor resultado lo obtuvo el Stereo Smile (91%), seguido del Random Dot E (81%) y, en último lugar, el Randot Preschool (71%).
En un estudio en el que participaron 139 niños de 4 a 12 años, la repetición de una prueba de estereopsis mostró un alto grado de variabilidad en los resultados, lo que cuestiona su valor como prueba de cribado83.
Combinación de pruebas de cribado
La revisión del USPSTF6 encontró cuatro estudios de calidad débil y uno de baja calidad que evaluaron la validez diagnóstica de la agudeza visual, la estereopsis y la alineación ocular en combinación, aunque en cada estudio variaron las pruebas concretas utilizadas. Estos estudios tuvieron en general un cociente de probabilidades mayor que los estudios que evaluaron pruebas individuales. La mediana del cociente de probabilidades positivo fue de 14 (rango de 4,8 a 17) y la mediana del cociente de probabilidades negativo fue de 0,28 (rango de 0,10 a 0,91). Ninguno de los estudios comparó diferentes combinaciones de pruebas ni el uso de varias pruebas combinadas frente a una prueba aislada. En el estudio VIP, la detección del estrabismo mejoró significativamente cuando se añadió la prueba de tapar-destapar realizada por profesionales de la visión o una prueba de estereopsis (Stereo Smile II) a las pruebas de refracción84.
¿Cuál es la efectividad del tratamiento de las alteraciones visuales en niños de uno a cinco años?
El impacto del cribado dependerá en parte del resultado obtenido con el tratamiento de la ambliopía, que consiste en la corrección de la refracción con lentes combinada o no con la aplicación de parches oclusivos, cristales opacos o penalización con atropina en el ojo no ambliope. Los principales factores que pueden influir en el resultado del tratamiento son la edad a la que se inicie, la intensidad de la ambliopía y el cumplimiento terapéutico.
La revisión del USPSTF6 encontró dos ensayos clínicos de buena calidad85,86 y uno de calidad débil87 que compararon el efecto de la oclusión frente a la no oclusión en la agudeza visual de niños con una edad media de cuatro a cinco años. Los autores no encontraron estudios que evaluaran el efecto del tratamiento en el rendimiento escolar o en otros resultados funcionales. Dos estudios incluyeron pacientes con ambliopía y trataron los errores de refracción con lentes antes de asignarlos al grupo que recibió oclusión o al de control86,87. El tercero comparó oclusión y gafas o solo gafas frente a no tratamiento en niños con error de refracción unilateral85. En todos los estudios la oclusión se asoció a una mejora de la agudeza visual, aunque las diferencias fueron pequeñas (algo menos de una línea de agudeza visual), por lo que los autores de la revisión concluyen que existe evidencia adecuada de que el tratamiento precoz de la ambliopía, en edades de tres a cinco años, produce mejores resultados en la visión, siendo el beneficio mayor en los casos de más intensidad de ambliopía.
Tres revisiones Cochrane han evaluado la efectividad del tratamiento de la ambliopía estrábica88, refractiva89 y por privación de estímulo90. En la primera se incluyeron tres estudios que evaluaron la mejoría de la agudeza visual alcanzada, un estudio piloto91 y dos ensayos clínicos. Uno de los ensayos estaba incluido en la revisión del USPSTF86 y el otro analizó el efecto de complementar la oclusión con actividades de visión de cerca92. La conclusión de los autores fue que la oclusión ocular añadida al uso de lentes parece ser más eficaz que la corrección refractiva sola en el tratamiento de la ambliopía estrábica. En la segunda revisión se analizaron 11 estudios, de los que 4 estaban incluidos en la revisión del USPSTF, uno se había analizado en la revisión Cochrane sobre el tratamiento de la ambliopía estrábica, uno era un estudio piloto y uno incluía niños mayores (7-17 años). Los autores obtienen la conclusión de que en algunos casos de ambliopía refractiva unilateral se obtiene mejoría de la agudeza visual con la corrección del error de refracción solamente; cuando la ambliopía persiste a pesar de las lentes, se puede alcanzar una mejoría adicional añadiendo parches oclusivos. En la tercera revisión no se encontró ningún ensayo clínico sobre el tratamiento de la ambliopía por privación de estímulo, por lo que no fue posible evaluar la efectividad del tratamiento.
La revisión sistemática de Solebo7 analizó los tres ensayos clínicos incluidos en la revisión del USPSTF6 en los que se comparó la oclusión frente a la no oclusión85-87. Aunque la distinta metodología de los ensayos no permitió hacer un metaanálisis, los autores de la revisión consideran que, en conjunto, proporcionan evidencia de que la oclusión se asocia a una mejora de la agudeza visual de 1 línea logMAR en niños ambliopes tratados a la edad de 3-5 años.
El estudio de Clarke85 incluyó 177 niños de tres a cinco años con error de refracción unilateral, pero no necesariamente con ambliopía, identificados mediante cribado. Los participantes fueron asignados aleatoriamente a tres grupos: gafas y oclusión, solo gafas o no tratamiento. En primer lugar se pautaron las lentes a los dos primeros grupos y a continuación se añadió el parche oclusivo a los individuos del primer grupo que tuvieran una disminución de la agudeza visual a pesar de las lentes. El seguimiento fue de 52 semanas. Los dos grupos de tratamiento tuvieron una mejoría de la agudeza visual corregida, pequeña aunque estadísticamente significativa. La diferencia respecto a los no tratados fue de 0,11 logMAR (IC 95: 0,05-0,17) para el grupo con gafas y oclusión y de 0,08 logMAR (IC 95: 0,02-0,15) para el grupo con gafas. La mejoría fue mayor para el subgrupo de niños con peor agudeza visual. Los que tenían una agudeza de 0,48 logMAR o peor al inicio del estudio y fueron tratados con gafas y oclusión tuvieron una mejoría de 0,26 logMAR (IC 95: 0,14-0,39) en comparación con los que no recibieron tratamiento; los que solo fueron tratados con gafas también tuvieron una mejoría mayor que los no tratados pero la diferencia no alcanzó significación estadística (0,11 logMAR; IC 95: -0,03 a 0,24). Al acabar el estudio se instauró tratamiento a los niños que no lo habían recibido. Seis meses después, no había diferencias significativas en la agudeza visual entre los grupos, por lo que los autores concluyen que retrasar un año el tratamiento no tiene impacto negativo a esta edad.
El Pediatric Eye Disease Investigator Group (PEDIG) realizó un ensayo multicéntrico que incluyó 180 niños de tres a siete años con ambliopía asociada a estrabismo o anisometropía a los que se había prescrito previamente (16 semanas antes) lentes para corregir el error de refracción86. Los participantes fueron aleatorizados en dos grupos: dos horas diarias de oclusión con parche o no tratamiento. Ambos grupos continuaron utilizando las lentes prescritas con anterioridad. La duración del estudio fue de cinco semanas, al cabo de las cuales la agudeza visual media en el ojo ambliope fue de 0,44 logMAR (DS 0,22) en el grupo con oclusión, frente a 0,51 (DS 0,28) en el grupo sin tratamiento, con una diferencia media de 0,07 logMAR (IC 95: 0,02-1,2; p=0,006), que es inferior a una línea de optotipos. La proporción de pacientes que tuvo una mejoría de 2 o más líneas de optotipos fue del 45% en el grupo de tratamiento y del 23% en los no tratados (p=0,003).
Awan87 publicó un estudio en el que se incluyeron 60 niños con ambliopía estrábica o mixta y una edad de ocho años o menos, que fueron aleatorizados durante 12 semanas en tres grupos: no oclusión, oclusión durante tres horas o seis horas de oclusión. Todos los niños con error de refracción (92% de los incluidos) utilizaban lentes para corregirlo desde seis semanas antes del inicio del estudio. La mejoría media de la agudeza visual en el ojo ambliope fue de 0,24 logMAR en el grupo que no recibió tratamiento, de 0,29 en el grupo de tres horas de oclusión y de 0,34 en el de seis horas (p=0,11).
En cuanto a los diferentes regímenes de tratamiento, en la revisión del USPSTF se analizó un estudio del grupo PEDIG que comparó la administración de atropina con el uso de parches y no encontró diferencias significativas93,94 ; dos estudios que compararon el tiempo de oclusión con el parche (dos horas diarias de oclusión frente a seis horas95 y seis horas frente a 1296 ), con resultados similares en todos los grupos en cuanto a cambios en la agudeza visual; y otro en el que no se encontraron y diferencias entre el uso diario de atropina en el ojo no ambliope frente a su administración en fin de semana97.
La revisión de Solebo7 identificó 19 ensayos clínicos que comparaban diferentes tratamientos, de los cuales cinco compararon distintos regímenes de oclusión con parche, siete analizaron la penalización con atropina frente a la oclusión ocular, uno comparaba la penalización con atropina a diario o en fin de semana y seis incluían otras modalidades de tratamiento. Los autores concluyen que no hay evidencia de que ningún régimen concreto sea superior, aunque los niños mayores y los que tienen grados más graves de ambliopía se benefician más de “dosis” mayores de oclusión. La penalización con atropina dos veces por semana obtiene resultados similares a la oclusión con parche en niños con ambliopía moderada; aunque puede tener efectos secundarios locales y sistémicos, el riesgo se compensa por el mayor impacto personal y social de la oclusión con parche.
No hay evidencia procedente de ensayos clínicos de que la estereopsis mejore con el tratamiento de la ambliopía, aunque en algunos estudios se observa una tendencia hacia una mejor visión estereoscópica con el tratamiento98,99.
En la Figura 1 (modificada de Birch100 ) se resumen los resultados de los diversos ensayos clínicos sobre el tratamiento de la ambliopía.
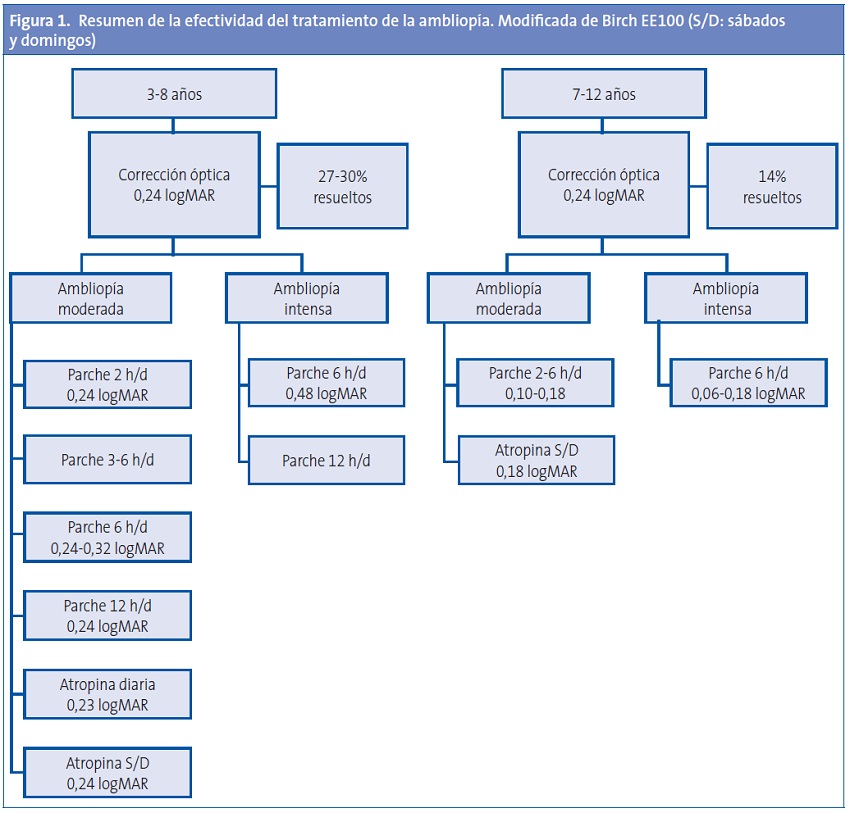
Cumplimiento terapéutico
Algunos estudios sugieren que el escaso cumplimiento terapéutico podría limitar la efectividad del tratamiento, aunque la revisión del USPSTF6 no encontró ensayos clínicos que hayan evaluado el efecto del cumplimiento en los resultados del tratamiento. En el estudio en que los niños fueron aleatorizados a recibir 6 o 12 horas diarias de oclusión, se comprobó que el tiempo real de uso del parche fue de cuatro horas (66%) y seis horas (50%) respectivamente96. En otro estudio con prescripción de tres o seis horas diarias de oclusión, el tiempo de cumplimiento fue del 57% y 41% respectivamente87.
Estabilidad del efecto terapéutico
No está bien establecida la estabilidad a largo plazo de la mejoría de la agudeza visual en los niños que han recibido tratamiento de la ambliopía. Se ha descrito que hasta un 25% de los niños pueden tener una disminución de la agudeza visual después de terminar el tratamiento101,102, aunque la revisión de Solebo7 no encontró ningún estudio a largo plazo sobre el resultado del tratamiento en la edad adulta.
En niños de uno a cinco años ¿influye la edad en la validez y factibilidad de las pruebas de cribado o en la efectividad del tratamiento?
El cribado en edades tempranas puede aumentar la tasa de falsos positivos o de niños que no pasan la prueba por falta de colaboración. Para evitar las derivaciones innecesarias o la repetición de la prueba se ha propuesto retrasar el cribado hasta el primer año de escolarización, aunque es posible que el retraso en el tratamiento de la ambliopía se asocie a unos resultados peores.
La validez diagnóstica de las pruebas de cribado no varía en niños estratificados por edad. Aunque hay pocos estudios que hayan comparado la factibilidad de las pruebas de cribado en niños de uno a tres años comparados con los de tres a cinco años, en general es menor a la edad de uno a tres años cuando se utilizan pruebas como los optotipos73 o el Random Dot E6. En el estudio VIP, la factibilidad de los optotipos Lea y HOTV fue superior al 95% a todas las edades entre los tres y los cinco años103, y la prueba Random Dot E fue factible en el 86% de los casos a la edad de tres años y en el 93% a los cinco años104.
Algunos estudios observacionales sugieren que la detección precoz de factores de riesgo ambliogénico como la hipermetropía o el estrabismo podrían mejorar el pronóstico y disminuir la prevalencia de ambliopía en edades posteriores, pero la baja calidad metodológica impide extraer conclusiones firmes105-107.
La evidencia sobre el impacto de la edad en la efectividad del tratamiento de la ambliopía es mixta. Ningún ensayo de tratamiento ha incluido niños menores de tres años6. En el rango de tres a ocho años, la mayoría de los estudios no han encontrado asociación entre la edad de inclusión y los resultados del tratamiento95,108. El grupo PEDIG comparó el tratamiento con oclusión frente a no tratamiento en niños de tres a siete años con ambliopía y no encontró diferencia entre la edad al inicio del estudio y los resultados en la visión86. En niños de tres a cinco años, retrasar un año el inicio del tratamiento con oclusión tampoco se asoció a peores resultados después de seis meses adicionales de seguimiento85. Un estudio con niños de tres a ocho años obtuvo resultados similares con oclusión durante menos de tres horas o durante de tres a seis horas diarias en los menores de cuatro años (p=0,54), pero en los mayores de esta edad los resultados en la agudeza visual fueron significativamente mejores con la oclusión durante de tres a seis horas comparada con la de menos de tres horas de duración (p=0,03)96. En el estudio ALSPAC, los resultados del tratamiento fueron ligeramente mejores en una cohorte de niños a los que se realizó el cribado a los 37 meses comparados con los que fueron cribados al inicio de la escolarización (4-5 años): la agudeza visual media fue de 0,14 logMAR (DS 0,18) en el grupo de cribado preescolar y de 0,2 (DS 0,23) en el grupo de cribado a los 4-5 años, siendo la diferencia estadísticamente significativa en el subgrupo de niños con ambliopía no estrábica (0,06 logMAR frente a 0,12; p=0,009) pero no en los que tenían estrabismo asociado a la ambliopía (0,27 frente a 0,29)53. Un metaanálisis de cuatro ensayos clínicos multicéntricos del grupo PEDIG, en el que se incluyeron 996 niños de 3 a 12 años, demostró que la eficacia del tratamiento no comienza a disminuir al menos hasta los cinco años58.
¿Cuáles son los riesgos del cribado de las alteraciones visuales en niños de uno a cinco años?
El cribado entraña un riesgo potencial de daño psicológico relacionado con el tratamiento, ansiedad por el etiquetado o derivaciones y tratamientos innecesarios en los falsos positivos. La revisión del USPSTF6 solo encontró un estudio de evaluación de los efectos psicosociales del cribado109 ; es un amplio estudio prospectivo de cohortes que forma parte del proyecto ALSPAC, en el que se observó una disminución del 50% en la odds ratio (OR) de padecer acoso escolar a la edad de 7,5 años entre niños a los que se había ofrecido el cribado visual a los 37 meses en comparación con los que no se les había ofrecido. El beneficio fue observado en los niños que recibieron tratamiento oclusivo (OR ajustada 0,39; IC 95: 0,16-0,92) pero no entre los tratados con lentes (OR ajustada 0,74; IC 95: 0,44-1,24), lo que sugiere que el cribado en edades tempranas se asociaría a un menor riesgo de acoso para los niños que utilizan tratamiento con parches oclusivos, probablemente porque lo terminan cuando son más pequeños.
Las tasas de falsos positivos varían en función de la prevalencia del trastorno buscado. En poblaciones con una prevalencia de trastornos visuales inferior al 10%, la tasa de falsos positivos es superior al 70%; cuando la prevalencia es de al menos el 20%, varía entre el 5% y el 39%6.
En un programa de fotocribado aplicado a 102 508 niños de uno a cinco años, el 19,5% de los falsos positivos (174 de 890) que no cumplían criterios diagnósticos de ambliopía o de factores de riesgo ambliogénico recibieron tratamiento con lentes por tener errores de refracción de significado incierto o incluso leves e intrascendentes110.
No se identificaron en la revisión del USPSTF6 estudios sobre los efectos del tratamiento innecesario con lentes en la visión a largo plazo o en los resultados funcionales, ni estudios sobre las tasas de tratamiento innecesario de la ambliopía o los factores de riesgo ambliogénico en los programas de cribado. En la revisión de Solebo7 no se encontraron estudios sobre los riesgos de las pruebas de cribado o de los procedimientos diagnósticos subsiguientes.
¿Cuáles son los riesgos del tratamiento de las alteraciones visuales en niños de uno a cinco años?
El tratamiento de la ambliopía se ha asociado a una pérdida reversible de la agudeza visual en el ojo no ambliope en algunos estudios. Se ha publicado una disminución de dos o más líneas de agudeza visual en el ojo no ambliope en el 8,8% de los niños tratados con oclusión, frente al 1,4% en los tratados con atropina (RR 0,93; IC 95: 0,88-0,97; p=0,001)93. Diecinueve de los 20 niños afectados habían recuperado la pérdida de agudeza visual en el ojo no ambliope a los dos años94. En otro ensayo, el uso de atropina y lente plana se asoció a un riesgo de pérdida de agudeza visual de ≥1 línea en el ojo no ambliope del 18% frente al 4% en los tratados solo con atropina (RR 0,86; IC 95: 0,78-0,95; p=0,004), que fue transitoria en 17 de los 18 niños afectados111. Pero estos datos no se han confirmado en otros estudios en los que el tratamiento no aumentó el riesgo de pérdida de agudeza visual en el ojo no ambliope86,95,97.
La evidencia procedente de ensayos clínicos sobre los efectos psicosociales adversos del tratamiento de la ambliopía se limitó, en la revisión del USPSTF6, a dos estudios. Uno, de calidad débil, cuya principal limitación es el seguimiento de pocos pacientes (78 de 177, un 44% de los incluidos inicialmente en el estudio), no encontró diferencias significativas en el bienestar emocional de los niños de cuatro años que fueron tratados con gafas, parches o gafas y parches respecto al grupo de no tratamiento, aunque a los niños y a sus padres les resultaba más molesto el uso de gafas y parches que el de las gafas solamente (85% frente a 29% a los cuatro años, p=0,03; 62% frente al 26% a los cinco años, p=0,01)112. Otro estudio evaluó mediante un cuestionario validado la respuesta de los niños y sus padres al tratamiento con atropina o con parches oclusivos113. Ambos grupos mostraron una disminución del bienestar emocional, aunque fue significativamente mayor (p<0,001) en el grupo tratado con parches que en el grupo de atropina. En la revisión del USPSTF6 se identificaron también algunos estudios observacionales en los que se asoció malestar psicológico y estigmatización al tratamiento de la ambliopía y otros en los que no se describe esta correlación.
El tratamiento con parches entraña el riesgo de irritación cutánea, que afectó al 5% de los niños en un ensayo clínico114. También se han descrito reacciones adversas, locales y sistémicas, con el uso de atropina en algunos ensayos clínicos del grupo PEDIG.
El cribado de las alteraciones visuales en niños de uno a cinco años ¿es coste-efectivo?
Un informe técnico sobre el coste-efectividad del cribado de alteraciones visuales en la infancia, realizado por el Instituto Aragonés de Ciencias de la Salud9, identificó 8 evaluaciones económicas sobre el cribado de la ambliopía y los factores de riesgo ambliogénico. Siete de ellas, de las que cinco fueron realizadas en Alemania y dos en EE. UU., consideran que las intervenciones son coste-efectivas. La restante es un informe de evaluación de tecnologías sanitarias sobre la efectividad y el coste-efectividad de los programas de cribado en preescolares, publicado en el Reino Unido en 20082, que estima que el coste por caso de ambliopía detectado es relativamente bajo (4000-6000 £), pero no es probable que ninguna estrategia de cribado sea coste-efectiva en términos de coste por años de vida ajustados por calidad (AVAC).
El informe técnico concluye que el coste por caso de ambliopía detectado parece ser relativamente bajo, pero el cribado solo sería coste-efectivo en términos monetarios por AVAC ganado si se asumen pérdidas de utilidad por discapacidad monocular permanente y, en realidad, no se conoce cuál es la pérdida de utilidad relacionada con déficit de visión monocular dado que no se ha investigado9.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
ABREVIATURAS: ALSPAC: Avon Longitudinal Study of Parents and Children • AV: agudeza visual • AVAC: años de vida ajustados por calidad • HOTV: escala usada para medir la agudeza visual (HOTV Eye Chart) • IC 95: intervalo de confianza del 95% • logMAR: logaritmo del ángulo mínimo de resolución • OR: odds ratio • PEDIG: Pediatric Eye Disease Investigator Group • RR: riesgo relativo • USPSTF: U. S. Preventive Services Task Force • VIP: Vision in Preschoolers Study.
BIBLIOGRAFÍA
- Matta NS, Silbert DI. Vision screening across the world. Am Orthoptic J. 2012;62:87-9.
- Carlton J, Karnon J, Czoski-Murray C, Smith KJ, Marr J. The clinical effectiveness and cost-effectiveness of screening programmes for amblyopia and strabismus in children up to the age of 4-5 years: A systematic review and economic evaluation. Health Technol Assess. 2008;12:iii,xi-194.
- Powell CC, Hatt SRS. Vision screening for amblyopia in childhood. Cochrane Database Syst Rev. 2009;3:CD005020.
- Powell C, Wedner S, Richardson S. Screening for correctable visual acuity deficits in school-age children and adolescents. Cochrane Database Syst Rev. 2005;1:CD005023.
- Morcos A, Wright M. National children’s vision screening project final report for department of health and aging, Murdoch children’s research institute. Melbourne, VIC: Centre for Community Child Health; 2009.
- Chou R, Dana T, Bougatsos C. Screening for Visual Impairment in Children Ages 1-5 Years: Systematic review to update the 2004 U.S. preventive services task force recommendation. Evidence synthesis no. 81. AHRQ Publication N.º 11-05151-EF-1. Rockville (MD): Agency for Healthcare Research and Quality; 2011.
- Solebo A, Rahi J. Vision screening in children aged 4-5 years. External review against programme appraisal criteria for the UK National Screening Committee (UK NSC) [en línea] [actualizado en 05/2013, consultado el 22/12/2014]. Disponible en: www.screening.nhs.uk/policydb_download.php?doc=365
- Snowdon SK, Stewart-Brown SL. Preschool vision screening. Health Technol Assess. 1997;1:i,iv,1-83.
- Gavín Benavent P, Monroy López F, Martín Sánchez J. Programa de actividades de detección precoz de problemas de salud entre los 0 y 14 años. Informe técnico sobre el coste-efectividad de las diferentes alternativas existentes en la detección precoz de problemas de visión en la edad pediátrica. Madrid: Ministerio de Economía y Competitividad; 2013. Informes de Evaluación de Tecnologías Sanitarias. IACS; 2014.
- Salomao SR, Ventura DF. Large sample population age norms for visual acuities obtained with vistech-teller acuity cards. Invest Ophthalmol Vis Sci. 1995;36:657-70.
- Mayer DL, Beiser AS, Warner AF, Pratt EM, Raye KN, Lang JM. Monocular acuity norms for the teller acuity cards between ages one month and four years. Invest Ophthalmol Vis Sci. 1995;36:671-85.
- Pan Y, Tarczy-Hornoch K, Cotter SA, Wen G, Borchert MS, Azen SP, et al. Visual acuity norms in pre-school children: the multi-ethnic pediatric eye disease study. Optom Vis Sci. 2009;86:607-12.
- Levi DM. Prentice award lecture 2011: Removing the brakes on plasticity in the amblyopic brain. Optom Vis Sci. 2012;89:827-38.
- Mutti DO. To emmetropize or not to emmetropize? the question for hyperopic development. Optom Vis Sci. 2007;84:97-102.
- Rahi JS, Dezateux C. British Congenital Cataract Interest Group. Measuring and interpreting the incidence of congenital ocular anomalies: lessons from a national study of congenital cataract in the UK. Invest Ophthalmol Vis Sci. 2001;42:1444-8.
- Riaño Galan I, Rodríguez Dehli C, García Lopez E, Moro Bayón C, Suárez Menéndez E, Ariza Hevia F, et al. Frecuencia y presentación clínica de los defectos oculares congénitos en Asturias (1990-2004). An Pediatr (Barc). 2010;72:250-6.
- Dimaras H, Kimani K, Dimba EA, Gronsdahl P, White A, Chan HS, et al. Retinoblastoma. Lancet. 2012;379:1436-46.
- MacCarthy A, Draper GJ, Steliarova-Foucher E, Kingston JE. Retinoblastoma incidence and survival in European children (1978-1997). Report from the automated childhood cancer information system project. Eur J Cancer. 2006;42:2092-102.
- American Academy of Pediatrics, Section on Ophthalmology, American Association for Pediatric Ophthalmology And Strabismus, American Academy of Ophthalmology, American Association of Certified Orthoptists. Red reflex examination in neonates, infants, and children. Pediatrics. 2008;122:1401-4.
- Rahi JS, Dezateux C. National cross sectional study of detection of congenital and infantile cataract in the United Kingdom: Role of childhood screening and surveillance. The British congenital cataract interest group. BMJ. 1999;318:362-5.
- Bhatti TR, Dott M, Yoon PW, Moore CA, Gambrell D, Rasmussen SA. Descriptive epidemiology of infantile cataracts in metropolitan Atlanta, GA, 1968-1998. Arch Pediatr Adolesc Med. 2003;157:341-7.
- Magnusson G, Bizjajeva S, Haargaard B, Lundstrom M, Nystrom A, Tornqvist K. Congenital cataract screening in maternity wards is effective: Evaluation of the paediatric cataract register of Sweden. Acta Paediatr. 2013;102:263-7.
- Eventov-Friedman S, Leiba H, Flidel-Rimon O, Juster-Reicher A, Shinwell ES. The red reflex examination in neonates: an efficient tool for early diagnosis of congenital ocular diseases. Isr Med Assoc J. 2010;12:259-61.
- Li J, Coats DK, Fung D, Smith EO, Paysse E. The detection of simulated retinoblastoma by using red-reflex testing. Pediatrics. 2010;126:e202-7.
- Abramson DH, Beaverson K, Sangani P, Vora RA, Lee TC, Hochberg HM, et al. Screening for retinoblastoma: presenting signs as prognosticators of patient and ocular survival. Pediatrics. 2003;112:1248-55.
- Butros LJ, Abramson DH, Dunkel IJ. Delayed diagnosis of retinoblastoma: analysis of degree, cause, and potential consequences. Pediatrics. 2002;109:E45.
- Lloyd IC, Ashworth J, Biswas S, Abadi RV. Advances in the management of congenital and infantile cataract. Eye (Lond). 2007;21:1301-9.
- Chak M, Wade A, Rahi JS, British Congenital Cataract Interest Group. Long-term visual acuity and its predictors after surgery for congenital cataract: Findings of the British congenital cataract study. Invest Ophthalmol Vis Sci. 2006;47:4262-9.
- Birch EE, Stager DR. The critical period for surgical treatment of dense congenital unilateral cataract. Invest Ophthalmol Vis Sci. 1996;37:1532-8.
- Canadian Retinoblastoma Society. National retinoblastoma strategy Canadian guidelines for care: Strategie therapeutique du retinoblastome guide clinique canadien. Can J Ophthalmol. 2009;44:S1-88.
- Magnusson G, Persson U. Screening for congenital cataracts: A cost-consequence analysis of eye examination at maternity wards in comparison to well-baby clinics. Acta Paediatr. 2005;94:1089-95.
- Holmes JM, Clarke MP. Amblyopia. Lancet. 2006;367:1343-51.
- Donahue SP, Arthur B, Neely DE, Arnold RW, Silbert D, Ruben JB, et al. Guidelines for automated preschool vision screening: a 10-year, evidence-based update. J AAPOS. 2013;17:4-8.
- Kleinstein RN, Jones LA, Hullett S, Kwon S, Lee RJ, Friedman NE, et al. Refractive error and ethnicity in children. Arch Ophthalmol. 2003;121:1141-7.
- Multi-ethnic Pediatric Eye Disease Study Group. Prevalence of amblyopia and strabismus in African American and Hispanic children ages 6 to 72 months the multi-ethnic pediatric eye disease study. Ophthalmology. 2008;115:1229,1236.e1.
- Friedman DS, Repka MX, Katz J, Giordano L, Ibironke J, Hawse P, et al. Prevalence of amblyopia and strabismus in white and African American children aged 6 through 71 months: the Baltimore pediatric eye disease study. Ophthalmology. 2009;116:2128,2134.e1-2.
- Pai AS, Rose KA, Leone JF, Sharbini S, Burlutsky G, Varma R, et al. Amblyopia prevalence and risk factors in Australian preschool children. Ophthalmology. 2012;119:138-44.
- Williams C, Northstone K, Howard M, Harvey I, Harrad RA, Sparrow JM. Prevalence and risk factors for common vision problems in children: data from the ALSPAC study. Br J Ophthalmol. 2008;92:959-64.
- Martinez J, Canamares S, Saornil MA, Almaraz A, Pastor JC. Original papers: Prevalence of amblyogenic diseases in a preschool population sample of Valladolid, Spain. Strabismus. 1997;5:73-80.
- Borchert M, Tarczy-Hornoch K, Cotter SA, Liu N, Azen SP, Varma R, et al. Anisometropia in Hispanic and African American infants and young children: The multi-ethnic pediatric eye disease study. Ophthalmology. 2010;117:148,153.e1.
- Multi-Ethnic Pediatric Eye Disease Study Group. Prevalence of myopia and hyperopia in 6- to 72-month-old African American and Hispanic children: The multi-ethnic pediatric eye disease study. Ophthalmology. 2010;117:140,147.e3.
- Fozailoff A, Tarczy-Hornoch K, Cotter S, Wen G, Lin J, Borchert M, et al. Prevalence of astigmatism in 6- to 72-month-old African American and Hispanic children: The multi-ethnic pediatric eye disease study. Ophthalmology. 2011;118:284-93.
- Colburn JD, Morrison DG, Estes RL, Li C, Lu P, Donahue SP. Longitudinal follow-up of hypermetropic children identified during preschool vision screening. J AAPOS. 2010;14:211-5.
- Woodruff G. Amblyopia: Could we do better? BMJ. 1995;310:1153-4.
- Rahi J, Logan S, Timms C, Russell-Eggitt I, Taylor D. Risk, causes, and outcomes of visual impairment after loss of vision in the non-amblyopic eye: a population-based study. Lancet. 2002;360:597-602.
- Van Leeuwen R, Eijkemans MJ, Vingerling JR, Hofman A, de Jong PT, Simonsz HJ. Risk of bilateral visual impairment in individuals with amblyopia: the Rotterdam study. Br J Ophthalmol. 2007;91:1450-1.
- Chua B, Mitchell P. Consequences of amblyopia on education, occupation, and long term vision loss. Br J Ophthalmol. 2004;88:1119-21.
- Rahi JS, Cumberland PM, Peckham CS. Does amblyopia affect educational, health, and social outcomes? findings from 1958 British birth cohort. BMJ. 2006;332:820-5.
- Wilson GA, Welch D. Does amblyopia have a functional impact? findings from the Dunedin multidisciplinary health and development study. Clin Experiment Ophthalmol. 2013;41:127-34.
- Carlton J, Kaltenthaler E. Amblyopia and quality of life: a systematic review. Eye (Lond). 2011;25:403-13.
- O'Connor AR, Birch EE, Anderson S, Draper H, FSOS Research Group. The functional significance of stereopsis. Invest Ophthalmol Vis Sci. 2010;51:2019-23.
- Eibschitz-Tsimhoni M, Friedman T, Naor J, Eibschitz N, Friedman Z. Early screening for amblyogenic risk factors lowers the prevalence and severity of amblyopia. J AAPOS. 2000;4:194-9.
- Williams C, Northstone K, Harrad RA, Sparrow JM, Harvey I, ALSPAC Study Team. Amblyopia treatment outcomes after preschool screening v school entry screening: Observational data from a prospective cohort study.
- Webber AL, Wood J. Amblyopia: prevalence, natural history, functional effects and treatment. Clin Exp Optom. 2005;88:365-75.
- Simons K, Preslan M. Natural history of amblyopia untreated owing to lack of compliance. Br J Ophthalmol. 1999;83:582-7.
- Scheiman MM, Hertle RW, Beck RW, Edwards AR, Birch E, Cotter SA, et al. Randomized trial of treatment of amblyopia in children aged 7 to 17 years. Arch Ophthalmol. 2005;123:437-47.
- Hertle RW, Scheiman MM, Beck RW, Chandler DL, Bacal DA, Birch E, et al. Stability of visual acuity improvement following discontinuation of amblyopia treatment in children aged 7 to 12 years. Arch Ophthalmol. 2007;125:655-9.
- Holmes JM, Lazar EL, Melia BM, Astle WF, Dagi LR, Donahue SP, et al. Effect of age on response to amblyopia treatment in children. Arch Ophthalmol. 2011;129:1451-7.
- Williams C, Northstone K, Harrad RA, Sparrow JM, Harvey I, ALSPAC Study Team. Amblyopia treatment outcomes after screening before or at age 3 years: Follow up from randomised trial. BMJ. 2002;324:1549.
- Kvarnstrom G, Jakobsson P, Lennerstrand G. Visual screening of Swedish children: An ophthalmological evaluation. Acta Ophthalmol Scand. 2001;79:240-4.
- Longmuir SQ, Pfeifer W, Leon A, Olson RJ, Short L, Scott WE. Nine-year results of a volunteer lay network photoscreening program of 147 809 children using a photoscreener in iowa. Ophthalmology. 2010;117:1869-75.
- Donahue SP, Johnson TM, Leonard-Martin TC. Screening for amblyogenic factors using a volunteer lay network and the MTI photoscreener. Initial results from 15,000 preschool children in a statewide effort. Ophthalmology. 2000;107:1637-44.
- Miller JM, Lessin HR; American Academy of Pediatrics Section on Ophthalmology; Committee on Practice and Ambulatory Medicine; American Academy of Ophthalmology; American Association for Pediatric Ophthalmology and Strabismus; et al. Instrument-based pediatric vision screening policy statement. Pediatrics. 2012;130:983-6.
- Maguire MG, Vision in Preschoolers Study Group. Children unable to perform screening tests in vision in preschoolers study: proportion with ocular conditions and impact on measures of test accuracy. Invest Ophthalmol Vis Sci. 2007;48:83-7.
- Bertuzzi F, Orsoni JG, Porta MR, Paliaga GP, Miglior S. Sensitivity and specificity of a visual acuity screening protocol performed with the lea symbols 15-line folding distance chart in preschool children. Acta Ophthalmol Scand. 2006;84:807-11.
- Miller JM, Harvey EM, Dobson V. Visual acuity screening versus noncycloplegic autorefraction screening for astigmatism in native American preschool children. J AAPOS. 1999;3:160-5.
- Miller JM, Dobson V, Harvey EM, Sherrill DL. Comparison of preschool vision screening methods in a population with a high prevalence of astigmatism. Invest Ophthalmol Vis Sci. 2001;42:917-24.
- Schmidt P, Maguire M, Dobson V, Quinn G, Ciner E, Cyert L, et al. Comparison of preschool vision screening tests as administered by licensed eye care professionals in the vision in preschoolers study. Ophthalmology. 2004;111:637-50.
- Ying GS, Kulp MT, Maguire M, Ciner E, Cyert L, Schmidt P, et al. Sensitivity of screening tests for detecting vision in preschoolers-targeted vision disorders when specificity is 94%. Optom Vis Sci. 2005;82:432-8.
- International Council of Ophthalmology. Visual acuity measurement standard. En International Council of Ophthalmology [en línea] [consultado el 22/12/2014]. Disponible en www.icoph.org/resources/47/Visual-Acuity-Measurement-Standard.html
- World Health Organization. Consultation on development of standards for characterization of vision loss and visual functioning: Geneva, 4-5 September 2003. World Health Organization [en línea] [consultado el 22/12/2014]. Disponible en www.who.int/blindness/partnerships/research/en/index.html
- The Royal College of Ophthalmologist. Statement on Visual Screening in Children and Young People. The Royal College of Ophthalmologist [en línea] [consultado el 22/12/2014]. Disponible en: http://goo.gl/VaxZCu
- Leone JF, Gole GA, Mitchell P, Kifley A, Pai AS, Rose KA. Visual acuity testability and comparability in Australian preschool children: The Sydney paediatric eye disease study. Eye (Lond). 2012;26:925-32.
- Sonksen PM, Wade AM, Proffitt R, Heavens S, Salt AT. The Sonksen logMAR test of visual acuity: II. Age norms from 2 years 9 months to 8 years. J AAPOS. 2008;12:18-22.
- Drover JR, Felius J, Cheng CS, Morale SE, Wyatt L, Birch EE. Normative pediatric visual acuity using single surrounded HOTV optotypes on the electronic visual acuity tester following the amblyopia treatment study protocol. J AAPOS. 2008;12:145-9.
- Committee on Practice and Ambulatory Medicine, Section on Ophthalmology. American Association of Certified Orthoptists, American Association for Pediatric Ophthalmology and Strabismus, American Academy of Ophthalmology. Eye examination in infants, children, and young adults by pediatricians. Pediatrics. 2003;111:902-7.
- Williams C, Harrad RA, Harvey I, Sparrow JM, ALSPAC Study Team. Screening for amblyopia in preschool children: Results of a population-based, randomised controlled trial. ALSPAC study team. Avon longitudinal study of pregnancy and childhood. Ophthalmic Epidemiol. 2001;8:279-95.
- Chang CH, Tsai RK, Sheu MM. Screening amblyopia of preschool children with uncorrected vision and stereopsis tests in eastern Taiwan. Eye (Lond). 2007;21:1482-8.
- Hope C, Maslin K. Random dot stereogram E in vision screening of children. Aust N Z J Ophthalmol. 1990;18:319-24.
- Ruttum MS, Nelson DB. Stereopsis testing to reduce overreferral in preschool vision screening. J Pediatr Ophthalmol Strabismus. 1991;28:131-3.
- Moll AM, Rao RC, Rotberg LB, Roarty JD, Bohra LI, Baker JD. The role of the random dot stereo butterfly test as an adjunct test for the detection of constant strabismus in vision screening. J AAPOS. 2009;13:354-6.
- Schmidt PP, Maguire MG, Moore B, Cyert L, Vision in Preschoolers Study Group. Testability of preschoolers on stereotests used to screen vision disorders. Optom Vis Sci. 2003;80:753-7.
- Adler P, Scally AJ, Barrett BT. Test–retest variability of randot stereoacuity measures gathered in an unselected sample of UK primary school children. Br J Ophthalmol. 2012;96:656-61.
- Vision in Preschoolers Study Group. Does assessing eye alignment along with refractive error or visual acuity increase sensitivity for detection of strabismus in preschool vision screening? Invest Ophthalmol Vis Sci. 2007;48:3115-25.
- Clarke MP, Wright CM, Hrisos S, Anderson JD, Henderson J, Richardson SR. Randomised controlled trial of treatment of unilateral visual impairment detected at preschool vision screening. BMJ. 2003;327:1251.
- Wallace DK, Pediatric Eye Disease Investigator Group, Edwards AR, Cotter SA, Beck RW, Arnold RW, et al. A randomized trial to evaluate 2 hours of daily patching for strabismic and anisometropic amblyopia in children. Ophthalmology. 2006;113:904-12.
- Awan M, Proudlock FA, Gottlob I. A randomized controlled trial of unilateral strabismic and mixed amblyopia using occlusion dose monitors to record compliance. Invest Ophthalmol Vis Sci. 2005;46:1435-9.
- Taylor K, Elliott S. Interventions for strabismic amblyopia. Cochrane Database Syst Rev. 2011;8:CD006461.
- Taylor K, Powell C, Hatt SR, Stewart C. Interventions for unilateral and bilateral refractive amblyopia. Cochrane Database Syst Rev. 2012;4:CD005137.
- Hatt S, Antonio-Santos A, Powell C, Vedula SS. Interventions for stimulus deprivation amblyopia. Cochrane Database Syst Rev. 2006;3:CD005136.
- Holmes JM, Edwards AR, Beck RW, Arnold RW, Johnson DA, Klimek DL, et al. A randomized pilot study of near activities versus non-near activities during patching therapy for amblyopia. J AAPOS. 2005;9:129-36.
- Pediatric Eye Disease Investigator Group. A randomized trial of near versus distance activities while patching for amblyopia in children aged 3 to less than 7 years. Ophthalmology. 2008;115:2071-8.
- Pediatric Eye Disease Investigator Group. A randomized trial of atropine vs. patching for treatment of moderate amblyopia in children. Arch Ophthalmol. 2002;120:268-78.
- Repka MX, Wallace DK, Beck RW, Kraker RT, Birch EE, Cotter SA, et al. Two-year follow-up of a 6-month randomized trial of atropine vs patching for treatment of moderate amblyopia in children. Arch Ophthalmol. 2005;123:149-57.
- Repka MX, Beck RW, Holmes JM, Birch EE, Chandler DL, Cotter SA, et al. A randomized trial of patching regimens for treatment of moderate amblyopia in children. Arch Ophthalmol. 2003;121:603-11.
- Stewart CE, Stephens DA, Fielder AR, Moseley MJ, ROTAS Cooperative. Objectively monitored patching regimens for treatment of amblyopia: Randomised trial. BMJ. 2007;335:707.
- Repka MX, Cotter SA, Beck RW, Kraker RT, Birch EE, Everett DF, et al. A randomized trial of atropine regimens for treatment of moderate amblyopia in children. Ophthalmology. 2004;111:2076-85.
- Richardson SR, Wright CM, Hrisos S, Buck D, Clarke MP. Stereoacuity in unilateral visual impairment detected at preschool screening: Outcomes from a randomized controlled trial. Invest Ophthalmol Vis Sci. 2005;46:150-4.
- Wallace DKD, Lazar ELE, Melia MM, Birch EEE, Holmes JMJ, Hopkins KBK, et al. Stereoacuity in children with anisometropic amblyopia. J AAPOS. 2011;15:455-61.
- Birch EE. Amblyopia and binocular vision. Prog Retin Eye Res. 2013;33:67-84.
- Holmes JM, Melia M, Bradfield YS, Cruz OA, Forbes B, Pediatric Eye Disease Investigator Group. Factors associated with recurrence of amblyopia on cessation of patching. Ophthalmology. 2007;114:1427-32.
- Holmes JM, Beck RW, Kraker RT, Astle WF, Birch EE, Cole SR, et al. Risk of amblyopia recurrence after cessation of treatment. J AAPOS. 2004;8:420-8.
- Vision in Preschoolers Study Group. Preschool visual acuity screening with HOTV and lea symbols: Testability and between-test agreement. Optom Vis Sci. 2004;81:678-83.
- Vision in Preschoolers Study Group, Schmidt P, Maguire M, Kulp MT, Dobson V, Quinn G. Random dot E stereotest: Testability and reliability in 3- to 5-year-old children. J AAPOS. 2006;10:507-14.
- Schmucker C, Kleijnen J, Grosselfinger R, Riemsma R, Antes G, Lange S, et al. Effectiveness of early in comparison to late(r) treatment in children with amblyopia or its risk factors: A systematic review. Ophthalmic Epidemiol. 2010;17:7-17.
- Donahue SP. Relationship between anisometropia, patient age, and the development of amblyopia. Am J Ophthalmol. 2006;142:132-40.
- Kirk VG, Clausen MM, Armitage MD, Arnold RW. Preverbal photoscreening for amblyogenic factors and outcomes in amblyopia treatment: Early objective screening and visual acuities. Arch Ophthalmol. 2008;126:489-92.
- Pediatric Eye Disease Investigator Group. A comparison of atropine and patching treatments for moderate amblyopia by patient age, cause of amblyopia, depth of amblyopia, and other factors. Ophthalmology. 2003;110:1632-7.
- Williams C, Horwood J, Northstone K, Herrick D, Waylen A, Wolke D, et al. The timing of patching treatment and a child's wellbeing. Br J Ophthalmol. 2006;90:670-1.
- Donahue SP. How often are spectacles prescribed to “normal” preschool children? J AAPOS. 2004;8:224-9.
- Pediatric Eye Disease Investigator Group. Pharmacological plus optical penalization treatment for amblyopia: Results of a randomized trial. Arch Ophthalmol. 2009;127:22-30.
- Hrisos S, Clarke MP, Wright CM. The emotional impact of amblyopia treatment in preschool children: Randomized controlled trial. Ophthalmology. 2004;111:1550-6.
- Holmes JM, Beck RW, Kraker RT, Cole SR, Repka MX, Birch EE, et al. Impact of patching and atropine treatment on the child and family in the amblyopia treatment study. Arch Ophthalmol. 2003;121:1625-32.
- Scheiman MM, Hertle RW, Kraker RT, Beck RW, Birch EE, Felius J, et al. Patching vs atropine to treat amblyopia in children aged 7 to 12 years: A randomized trial. Arch Ophthalmol. 2008;126:1634-42.






