Vol. 27 - Num. 106
Grupo PrevInfad/PAPPS Infancia y Adolescencia
Cribado de ferropenia en menores de cinco años
Ana Gallego Iborraa, José Galbe Sánchez-Venturab, Ana Garach Gómezc, Laura García Sotod, Juan Hidalgo Sanze, Leyre Martí Martíf, José M.ª Mengual Gile, Carmen Rosa Pallás Alonsog, Julia Colomer Revueltah, Olga Cortés Ricoi, M.ª Jesús Esparza Olcinaj
aPediatra. Unidad de Seguimiento y Neurodesarrollo. Distrito Sanitario Málaga-Guadalhorce. Málaga. España
bPediatra. CS Torrero La Paz. Zaragoza. España.
cPediatra. CS Zaidín Sur. Granada. España.
dPediatra. CS Rute. Córdoba. España
ePediatra. CS Las Fuentes Norte. Zaragoza. España.
fPediatra. CS Faura. Valencia. España
gServicio de Neonatología. Hospital Universitario 12 de Octubre. Madrid. España.
hPediatra. Departamento de Pediatría. Universidad de Valencia. España.
iPediatra. CS Canillejas. Madrid. España
jPediatra. Madrid. España.
Correspondencia: A Gallego. Correo electrónico: anagallegoiborra@gmail.com
Cómo citar este artículo: Gallego Iborra A, Galbe Sánchez-Ventura J, Garach Gómez A, García Soto L, Hidalgo Sanz J, Martí Martí L, et al. Cribado de ferropenia en menores de cinco años . Rev Pediatr Aten Primaria. 2025;27:183-92. https://doi.org/10.60147/6910a0f1
Publicado en Internet: 09-06-2025 - Número de visitas: 6269
Resumen
Además de ser esencial para el transporte de oxígeno, el hierro es también un componente estructural de muchas enzimas que lo hacen indispensable para una amplia gama de procesos metabólicos, tales como la actividad fagocítica antimicrobiana, la síntesis de ADN o la respiración celular.
Tiene un papel primordial en el neurodesarrollo, al intervenir en la síntesis de neurotransmisores, en la arborización dendrítica y en la mielinización. Durante la vida fetal y los primeros años de la infancia, momento de máximo desarrollo cerebral, un déficit férrico puede implicar afectación cognitiva, motórica, del aprendizaje y de la conducta, que en algunos casos podría ser irreversible. La ferropenia puede ser considerada, además de un déficit nutricional, un factor de riesgo neurológico.
Dada la importancia del micronutriente, cuyo déficit en la mayoría de las ocasiones es asintomático, y que, en caso de no tratarse puede, además de producir anemia, tener consecuencias en el desarrollo infantil a corto y medio plazo, se propone la revisión de las evidencias disponibles en relación con el cribado de la ferropenia en niños menores de cinco años. Tomamos como marco el documento previo del grupo PrevInfad, con revisión de la bibliografía posterior a este.
Palabras clave
● Cribado ● Ferropenia ● NeurodesarrolloNota:
Este manuscrito es una colaboración del grupo PrevInfad con la Revista Pediatría de Atención Primaria y es una versión adaptada del mismo tema publicado en la web de PrevInfad.
PREVALENCIA Y MAGNITUD DEL PROBLEMA
La ferropenia es el déficit nutricional más frecuente en la infancia. La Organización Mundial de la Salud (OMS)1 estima que el 43% de los niños del planeta presentan anemia, y de ellos el 42% es por déficit de hierro. La anemia es especialmente prevalente en el centro y oeste de África y en el sur de Asia. En Estados Unidos se calcula que un 15% de los niños de entre 1 y 3 años tiene déficit férrico y que más de un 5% tiene anemia ferropénica. En Europa2 los niños de entre 3 y 36 meses tuvieron prevalencias dispares: cercanas al 50% en países del este, y por debajo del 5% en la Europa Occidental.
En España3, un estudio transversal llevado a cabo en Almería (2020) que incluía 951 niños de entre 1 y 11 años encontró una prevalencia de ferropenia del 7,7% y de anemia ferropénica del 0,9%. El análisis multivariante identificó como factores independientes de riesgo: menores de cinco años con una prevalencia de ferropenia de 8,7% (odds ratio [OR]: 2,2; intervalo de confianza del 95% [IC 95%]: 1,35-3,6); consumo excesivo de leche de vaca y productos lácteos (OR: 1,87; IC 95%: 1,13-3,1) y pobre ingesta de verduras (OR: 2,7; IC 95%: 1,2-6,1).
Los factores de riesgo de ferropenia4 incluyen factores prenatales (anemia ferropénica materna grave, diabetes materna, crecimiento intrauterino retardado) neonatales (prematuridad, hemorragias) y durante la lactancia (ausencia de alimentación complementaria en mayores de seis meses, exceso de lácteos, enfermedades malabsortivas).
Los efectos deletéreos del déficit férrico parecen ser más intensos en función de la intensidad, la duración y la precocidad de este5,6. Además del efecto que pueda acarrear la anemia, la falta de hierro por sí sola es capaz de producir efectos negativos sobre el desarrollo cerebral; modelos preclínicos hablan de periodos sensibles y mecanismos epigenéticos hierro-sensibles, responsables no solo de trastornos del neurodesarrollo, sino de efectos que aparecerían en la edad adulta en forma de trastornos de salud mental.
Buscando actuaciones preventivas precoces7, se ha estudiado el efecto de suplementos maternos8,9 o de camplaje tardío del cordón sobre el neurodesarrollo10,11. En cuanto al manejo de las embarazadas, parece indicado el cribado de su nivel férrico, y el camplaje tardío del cordón ha demostrado mejoras en los parámetros hematológicos inmediatos del recién nacido, aunque los resultados neurológicos a medio y largo plazo no son concluyentes12.
La lactancia materna13 proporciona hierro suficiente para el lactante a término durante los primeros seis meses. Por otro lado, se mantiene la indicación de suplementos férricos en prematuros14,15.
Conocidos los posibles factores de riesgo (Figura 1) y factores protectores, y teniendo en cuenta que en la mayoría de las ocasiones la ferropenia es asintomática, el planteamiento de un cribado en niños pequeños necesitará valorar medidas de detección, medidas terapéuticas y su efecto sobre los resultados en salud a corto, medio y largo plazo. En cuanto a la eficacia de la terapia con hierro oral (sulfato ferroso) en la mejora de parámetros bioquímicos y hematológicos16, disponemos de datos que muestran que el tratamiento durante 12 semanas aumenta los depósitos corporales de hierro y previene la aparición de anemia17, con escasos efectos secundarios.
| Figura 1. Factores de riesgo de ferropenia |
|---|
 |

Se revisarán, por tanto, la actualización en medidas diagnósticas y resultados en salud.
MARCO ANALÍTICO
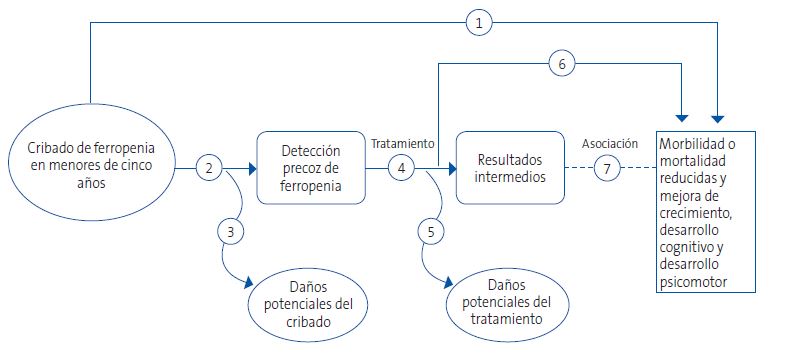
El marco analítico del que se desprenden las preguntas estructuradas se representa en la Figura 2.
| Figura 2. Cribado de ferropenia en menores de cinco años: marco analítico |
|---|
 |

PREGUNTAS ESTRUCTURADAS
1. Hacer cribados de ferropenia en menores de cinco años ¿supone mejorar resultados en salud? ¿mejora el crecimiento, el desarrollo cognitivo o el desarrollo psicomotor?
No disponemos de estudios que evalúen la eficacia del cribado de ferropenia en niños asintomáticos sobre los resultados en la salud: mejoría de la calidad de vida, mejoría en la somatometría, mejoría en el neurodesarrollo.
Al no disponer de evidencia directa, se buscará respuesta a eslabones intermedios de la cadena.
2. ¿Disponemos de pruebas precisas para detectar la ferropenia en menores de cinco años?
Las cifras de hemoglobina y el hematocrito definen la presencia o no de anemia, pero no proporcionan información de los depósitos de hierro. Microcitosis o hipocromía no son exclusivos de ferropenia. Índices eritrocitarios normales no excluyen ferropenia.
a) Nuevos índices de glóbulos rojos:
- Contenido de hemoglobina reticulocitaria: se considera un medidor en tiempo real de ferropenia funcional. No es un reactante de fase aguda.
Algunos estudios lo plantean como una alternativa barata para ser usada como única prueba de cribado18. Pero también se altera en talasemia, y lo más importante es la variabilidad de punto de corte entre los distintos estudios (entre 25 y 33,5 pg). La Sociedad Británica de Hematología plantea que, mientras no estén claros los límites, cifras menores de 29 pg apoyarían el diagnóstico de ferropenia si el resto de las pruebas no son concluyentes.
- Porcentaje de células rojas hipocrómicas: refleja el estado del hierro en los tres meses previos19. Un valor superior al 5% sugiere ferropenia. Pero el recuento se ve afectado por el transporte, debiendo ser analizada la muestra en las 3 o 4 horas tras la extracción.
b) Hierro:
- Hierro: además de ser reactante de fase aguda, sus niveles varían incluso a lo largo del día, por lo que no es útil para medir los depósitos férricos17.
- Saturación de transferrina: dependiente del hierro sérico y de la capacidad de la transferrina de unirse a él, tiene mejor rendimiento diagnóstico que ambos parámetros por separado. Un índice disminuido apoyaría el diagnóstico de ferropenia si el resto de los datos no fueran concluyentes.
- Receptor sérico de la transferrina: derivado de la proteólisis del receptor de membrana, aumenta en caso de déficit férrico. No es un reactante de fase aguda20. Como inconvenientes: es caro, no siempre está disponible, no es precoz y no disponemos de puntos de corte consensuados. No se recomienda para detectar ferropenia.
Se encuentran en estudio las ventajas que podrían ofrecer ciertos índices, como el receptor sérico/ferritina y el índice logarítmico21: receptor sérico de transferrina/logaritmo de ferritina.
c) Nuevos parámetros:
- Protoporfirina zinc: aunque en los primeros estudios mostraba buena sensibilidad y especificidad22 no parece tener buen poder predictivo. Aumenta en caso de ferropenia, pero también lo hace en la intoxicación por plomo y en anemias sideroblásticas17. Esto, unido a su escasa disponibilidad, hace que no se pueda recomendar como prueba de cribado de ferropenia.
- Eritroferrona: hormona producida por los eritroblastos que aumenta la absorción y movilización del hierro, por lo que se eleva en caso de ferropenia. No está establecido como parámetro clínico habitual23.
- Hepcidina: hormona sintetizada en el hígado que se une específicamente a la ferroportina, proteína transmembrana expresada en las células que movilizan hierro; dicha unión inhibe la absorción intestinal del mismo y la liberación del almacenado en los macrófagos20.
Niveles elevados en procesos inflamatorios (incluyendo obesidad) y disminuidos en caso de ferropenia (excepto en anemia ferropénica no respondedora genéticamente determinada). Los métodos actuales de medición son específicos, pero poco sensibles, por lo que no se recomienda para la valoración de déficit férrico.
d) Ferritina:
Marcador más precoz y específico de los depósitos corporales de hierro, con correlación demostrada con los niveles de este en médula ósea17.
Es un reactante de fase aguda, por lo que niveles normales o elevados no descartan ferropenia; niveles bajos son diagnósticos de deficiencia de hierro.
En el año 2020 la OMS1 recomienda el uso de la ferritina para el diagnóstico de ferropenia en individuos sanos (fuerte recomendación, aunque con baja certeza de evidencia). En función de la población, recomienda pedir al unísono reactantes de fase aguda y, en caso de ser positivos, el punto de corte de normalidad sería 30 µg/l. En caso de ausencia de inflamación, niveles inferiores a 12 µg/l de ferritina serían diagnósticos de ferropenia en menores de cinco años, mientras que a partir de esa edad el punto de corte sería 15 µg/l.
Sin embargo, no hay unanimidad en la recomendación de estos valores. Cochrane24 en su revisión de 2021 afirma que la ferritina puede ser segura para diagnosticar ferropenia en individuos sintomáticos, pero que no se dispone de la suficiente robustez como para postular cifras diagnósticas en caso de ausencia de síntomas ni de sobredosis de hierro.
Con el objetivo de recomendar cifras basadas en fisiopatología y no en estudios poblacionales, en 2021 se publica un estudio relacionando las cifras de ferritina a partir de las cuales se empieza a modificar el receptor sérico de la transferrina y la hemoglobina, concluyendo que en niños la cifra adecuada sería 20 µg/l25.
Un estudio canadiense26 relacionó niveles de ferritina con función cognitiva en niños de 1 a 3 años, sugiriendo que puntos de corte entre 17 y 18 µg/l serían más adecuados que los postulados por la OMS, mientras que otros autores lo elevan a 24-25 µg/l en niños menores de un año27.
Aunque puede que un margen de seguridad sugiriera alcanzar niveles más altos, los niveles aconsejados por la OMS son diagnósticos de ferropenia y son los preconizados por la Sociedad Británica de Hematología28.
No quedan claros, por tanto, los niveles de ferritina adecuados para asegurar la normalidad de nivel de hierro en tejido cerebral.
3. ¿Cuáles serían los daños potenciales de cribar la ferropenia en menores de cinco años?
No se encontraron estudios diseñados para valorar los daños potenciales del cribado. Además de los inherentes a cualquier cribado masivo (ansiedad, falsos positivos, coste), sería deseable disponer de métodos no invasivos29.
En relación con los métodos no invasivos, distintas técnicas en investigación son prometedoras, pero aún no se dispone de suficiente evidencia o de valores de referencia para recomendar su uso: hepcidina en orina, protoporfirina zinc medida en el labio30 o ferritina en saliva31.
4 y 5. La mejoría de los parámetros bioquímicos y hematológicos con escasos efectos secundarios tras el tratamiento con hierro, como previamente se comentó, no precisa revisión.
6. ¿El tratamiento de la ferropenia en niños menores de cinco años mejora su crecimiento y su desarrollo psicomotor? ¿disminuye la mortalidad?
Aunque sabemos que el tratamiento con hierro en niños pequeños mejora los niveles corporales del mismo, sería importante conocer si dicha suplementación tiene efectos a medio o largo plazo en resultados de salud, tanto en crecimiento somático como en neurodesarrollo.
En consonancia, con las funciones conocidas del hierro, el estudio electrofisiológico de lactantes ferropénicos de seis meses evidencia retrasos madurativos del sistema nervioso: mielinización, crecimiento dendrítico y neurotransmisores (dopamina, serotonina y neuroepinefrina), con lo que ello puede suponer para los distintos dominios del desarrollo funcional32. Los lactantes con ferropenia de entre 6 y 24 meses de edad están en riesgo de tener peores resultados cognitivos, motores y socioemocionales33. Parece haber una relación no lineal (p = 0,02) entre niveles de ferritina y resultados en inventarios de desarrollo, según muestra un estudio de cohortes en niños de entre 1 y 3 años32. Estudios observacionales retrospectivos dan cuenta de peores resultados académicos y emocionales a los 25 años en el grupo que había padecido ferropenia crónica en la lactancia34. Pero, ¿sabemos si los resultados habrían sido diferentes de haber sido tratados con hierro?
Con el objetivo de examinar la influencia individual y conjunta sobre el funcionamiento neurocognitivo de los adolescentes de factores como ferropenia, suplementación con hierro, estrés familiar en la lactancia y estrés en la adolescencia, se llevó a cabo un estudio de cohortes con adolescentes de nivel socioeconómico medio bajo en Chile35; previamente habían formado parte de un ensayo clínico de suplementación férrica. Los autores llegan a la conclusión de que todos los factores estudiados tienen efecto sobre distintos aspectos conductuales posteriores, poniendo énfasis en la importancia de los factores estresantes. En cuanto al desarrollo motor, los adolescentes que habían sido suplementados tenían mejores parámetros si previamente eran deficitarios de hierro, y no si tenían niveles normales; entre los no suplementados, la valoración de la función motora fue mejor en los que tenían niveles adecuados de hierro. Un estudio realizado en Turquía36 mostró diferencias en el desarrollo motor y cognitivo entre lactantes ferropénicos, anémicos y controles; tras tres meses de tratamiento, las diferencias fueron menores: el componente motor mejoró en los anémicos, y el cognitivo tanto en los anémicos como en los ferropénicos. Los grupos no eran equiparables (mayores tasas de lactancia materna y nivel educativo en el grupo control) y sobre todo no se comparó con placebo, con cegamiento simple.
En 2013 se llevó a cabo una revisión Cochrane con objeto de conocer los efectos de la terapia con hierro sobre el desarrollo motor y la función cognitiva en menores de 3 años con anemia ferropénica. Los ensayos que valoraron la evolución dentro de los 30 días tras el tratamiento no demostraron cambios en el componente motor ni en la maduración cognitiva. En cuanto a los estudios que evaluaron después de 30 días de terapia, uno de ellos a los dos meses informó de una diferencia de 0,8 en la escala de Denver (IC 95%: -0,18-1,78; p = 0,11), mientras que el otro estudio mostró diferencias entre el grupo de intervención y el grupo placebo después de cuatro meses de tratamiento en la escala de Bayley. Los autores concluyen que no encontraron pruebas de que la terapia con hierro en niños pequeños con anemia ferropénica tuviese efecto en el desarrollo motor o cognitivo medido en el primer mes tras la terapia, que los efectos a largo plazo no son concluyentes, precisándose estudios de seguimiento durante la lactancia37.
La US Preventive Services Task Force (USPSTF) publicó en 201538 una revisión sobre efectividad y daños de la suplementación y cribado de ferropenia en niños entre 6 y 24 meses en países desarrollados, sin encontrar estudios que evaluaran los beneficios del cribado, ya que no daban respuesta a la correlación entre mejoría del nivel férrico tras la terapia y mejoría en crecimiento o neurodesarrollo. No recomendaban, por tanto, el cribado universal, si bien dejaban aparte la consideración en niños con factores de riesgo o con síntomas39.
Con objeto de valorar el efecto de suplementos de hierro en población con alta prevalencia de anemia sobre el desarrollo cognitivo, se llevó a cabo un estudio a gran escala de Bangladesh, publicado recientemente. Se reclutaron 3300 lactantes con asignación aleatoria a tres grupos (suplementos hierro, suplementos micronutrientes y placebo) que recibieron régimen terapéutico durante tres meses. No se observaron diferencias en cuanto a crecimiento o neurodesarrollo tras la pauta recibida ni a los 9 meses de concluida esta40: diferencia de medias en domino cognitivo respecto al nivel previo: -0,3 puntos (IC 95%: -0,55-0,48). El análisis de subgrupos mostró mejoría de los parámetros hematológicos en los que partían de ferropenia con/sin anemia en el grupo de intervención, pero no se encontraron diferencias en peso, talla ni escalas de neurodesarrollo.
Un estudio que valora la capacidad proactiva y reactiva en adolescentes mediante neuroimagen detectó diferencias entre los que tuvieron ferropenia en época fetal, durante la lactancia y un grupo control sin ferropenia, y concluye que, a pesar del tratamiento con hierro (que recibieron los que tenían anemia a los 9 meses), las diferencias en la actividad cerebral persisten, y son diferentes según el periodo afecto41.
Un ensayo clínico reciente no ha encontrado beneficios en el desarrollo psicomotor mediante la suplementación con hierro en lactantes a término sanos, sin factores de riesgo de ferropenia y alimentados con lactancia materna.
No disponemos, por tanto, de pruebas que demuestren que el tratamiento con hierro en lactantes con/sin ferropenia o con/sin anemia suponga una mejoría a medio plazo del crecimiento ni del neurodesarrollo.
¿Hay beneficios de cribado universal sobre cribado selectivo?
No se encontraron estudios prospectivos que compararan resultados en salud entre población con cribado universal y cribado selectivo dirigido a grupos de riesgo de ferropenia.
En Canadá se llevó a cabo un estudio de coste utilidad comparando el cribado universal frente a cribado selectivo en población de riesgo mediante la medición de ferritina en lactantes de 18 meses durante la visita de salud43. Usan un modelo teórico de decisiones a partir de prevalencias, costes estimados y años de vida ajustados por calidad, concluyendo que el incremento de costes que supondría el cribado universal podría ser efectivo sobre no cribar o hacer un cribado dirigido. Parten del concepto de que el tratamiento con hierro mejoraría los resultados neurológicos a largo plazo, hecho del que no disponemos evidencia; y en población de riesgo solo incluyen lactancias maternas prolongadas no complementadas, obesidad e ingesta de más de 500 ml de leche de vaca al día (consideran de riesgo la coexistencia de al menos dos factores). Aun así, calculan que el 35,5% de la población general estaría en riesgo. Pero excluyen factores de riesgo de ferropenia importantes, como las anemias gestacionales graves, los crecimientos intrauterinos retardados (10%), los prematuros (INE España, 2021; 6,67% del total de partos; menos de 32 semanas; 1-2% del total de nacimientos), hemorragias neonatales, consumo de leche de vaca en menores de 12 meses y la patología malabsortiva. De haber sido incluidos, puede que el resultado final hubiera sido diferente.
RECOMENDACIONES PRÁCTICAS EN CONSULTA
Se mantiene la recomendación de la lactancia materna como la mejor manera de proporcionar entre otros beneficios el hierro necesario al lactante. En caso de fórmula artificial, deberán ser fortificadas aun cuando los niveles aconsejables en las fórmulas de continuación no están claros, y son divergentes entre distintos grupos de expertos. El Reglamento Europeo 2016/127, de 25 de septiembre de 2015 por el que se regulan los requisitos específicos de composición y de información de los preparados de inicio y de continuación44, recomienda 0,3-1,3 mg/100 kcal (2,1-9,1 mg/l) en las fórmulas de inicio y 0,6-2 mg/100 kcal (3,6 a 14 mg/l) en las de continuación.
En el lactante de más de seis meses, hay que prestar especial atención a los retrasos en la introducción de la alimentación complementaria rica en hierro. En el mayor de 12 meses la ingesta de lácteos superior a 500 ml/día supone un riesgo de ferropenia (si la ingesta supera los 600, se incrementa el riesgo no solo de ferropenia, sino de anemia)45.
Los prematuros recibirán suplementos en forma de sulfato ferroso desde el mes de edad durante el primer año de vida o hasta que la alimentación complementaria garantice los aportes recomendados. La dosis dependerá de la edad gestacional y del tipo de lactancia46,47.
VALORACIÓN DE LA EVIDENCIA
El mejor parámetro del que disponemos para conocer los depósitos corporales de hierro es la ferritina. Los niveles protectores del desarrollo cerebral no quedan claros, al ser los resultados de los distintos estudios inconsistentes. Dicha inconsistencia determina que la calidad de la evidencia sobre los puntos de corte de los niveles de ferritina sea baja.
No disponemos de pruebas concluyentes de que la terapia con hierro mejore el desarrollo cognitivo de los niños: hay inconsistencia en los resultados de los distintos estudios, e incluso incertidumbre, al estar referidos a distintos grupos etarios y distintos dominios del neurodesarrollo. Asimismo, la evidencia es baja sobre el efecto del tratamiento con hierro sobre el desarrollo neurológico.
Habida cuenta de que los factores de riesgo de ferropenia son conocidos, parece razonable cribar a la población de riesgo, con el objetivo de al menos mejorar sus depósitos férricos, aunque no tengamos pruebas de que podamos con ello optimizar su neurodesarrollo. En todo caso, los beneficios superarían a los riesgos.
RECOMENDACIONES DE PREVINFAD
1. Se sugiere no hacer cribado universal de ferropenia en menores de cinco años
Calidad de evidencia: baja.
Fuerza de la recomendación: débil en contra.
2. Se sugiere hacer cribado de ferropenia en los niños de menos de cinco años con factores de riesgo
Calidad de evidencia: baja.
Fuerza de la recomendación: débil a favor.
CONFLICTO DE INTERESES
Los autores declaran no presentar conflictos de intereses en relación con la preparación y publicación de este artículo.
RESPONSABILIDAD DE LOS AUTORES
Contribución de los autores: investigación y redacción del manuscrito (AGI), deliberaciones, asesoramiento y apoyo en la redacción (todos).
ABREVIATURAS
IC 95%: intervalo de confianza del 95% · OMS: Organización Mundial de la Salud · OR: odds ratio.
BIBLIOGRAFÍA
- WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. En: WHO [en línea] [consultado el 29/05/2025]. Disponible en www.who.int/publications/i/item/9789240000124.
- Eussen S, Alles M, Uijterschout l, Brus F, Van Der Horst-Graat J. Iron intake and status of children aged 6-36 months in Europe: A systematic review. Ann Nutr Metab. 2015;66:80-92. https://doi.org/10.1159/000371357
- López Ruzafa E, Vázquez López MA, Galera Martínez R, Lendínez Molinos F, Gómez Bueno S, Martín González M. Prevalence and associated factors of iron deficiency in Spanish children aged 1 to 11 years. Eur J Pediatr. 2021;180(9):2773-80. https://doi.org/10.1007/s00431-021-04037-8
- Gedfie S, Getawa S, Melku M. Prevalence and Associated Factors of Iron Deficiency and Iron Deficiency Anemia Among Under-5 Children: A Systematic Review and Meta-Analysis. Glob Pediatr Health. 2022;9:2333794X221110860. https://doi.org/10.1177/2333794X221110860
- Georgieff MK. The importance of iron deficiency in pregnancy on fetal, neonatal, and infant neurodevelopmental outcomes. Int J Gynaecol Obstet. 2023;162(S2):83-8. https://doi.org/10.1002/ijgo.14951
- Aksu T, Ünal S. Iron deficiency Anemia in Infancy, Childhood and Adolescence. Turk Arch Pediatr. 2023;358-62. https://doi.org/10.5152/TurkArchPediatr.2023.23049
- Sundararajan S, Rabe H. Prevention of iron deficiency anemia in infants and toddlers. Pediatr Res. 2021;89:63-73. https://doi.org/1038/s41390-020-0907-5
- Jayasinghe C, Polson R, Van Woerden HC, Wilson P. The effect of universal maternal antenatal iron supplementation on neurodevelopment in offspring: A systematic review and meta-analysis. BMC Pediatr. 2018;18:150. https://doi.org/10.1186/s12887-018-1118-7
- Iglesias l, Canals J, Arija V. Effects of prenatal iron status on child neurodevelopment and behavior: A systematic review. Crit Rev Food Sci Nutr. 2018;58(10):1604-14. https://doi.org/10.1080/10408398.2016.1274285
- Andersson O, Lindquist B, Lindgren M, Stjernqvist K, Domellöf M, Hellström-Westas l. Effect of delayed cord clamping on neurodevelopment at 4 years of age: A randomized clinical trial. JAMA Pediatr. 2015;169(7):631-8. https://doi.org/10.1001/jamapediatrics.2015.0358
- Rabe H, Mercer J, Erickson-Owens D. What does the evidence tell us? Revisiting optimal cord management at the time of birth. Eur J Pediatr. 2022;181:1797-807. https://doi.org/10.1007/s00431-022-04395-x
- Cusick SE, Georgieff MK, Rao R. Approaches for reducing the risk of early-life iron deficiency-induced brain dysfunction in children. Nutrients. 2018;10:227. https://doi.org/3390/nu10020227
- Victora CG, Lessa Horta B, Loret de Mola C, Quevedo l, Tavares Pinheiro R, Gigante DP, et al. Association between breastfeeding and intelligence, educational attainment, and income at 30 years of age: a prospective birth cohort study from Brazil. Lancet Glob Health. 2015;3:e199-205. https://doi.org/10.1016/S2214-109X(15)70002-1
- Moreno Fernández J, Ochoa JJ, Latunde Dada GO, Díaz Castro J. Iron deficiency and iron homeostasis in low birth weight preterm infants: A systematic review. Nutrients. 2019;11:1090. https://doi.org/10.3390/nu11051090
- McCarthy EK, Dempsey EM, Kiely ME. Iron supplementation in preterm and low-birth-weight infants: A systematic review of intervention studies. Nutr Rev. 2019;77:865-77. https://doi.org/10.1093/nutrit/nuz051
- Powers JM, Buchanan GR, Adix l, Zhang S, Gao A, McCavit TL. Effect of Low-Dose Ferrous Sulfate vs Iron Polysaccharide Complex on Hemoglobin Concentration in Young Children With Nutritional Iron-Deficiency Anemia: A Randomized Clinical Trial. JAMA. 2017;317(22):2297-304. https://doi.org/10.1001/jama.2017.6846
- Mattiello V, Schmugge M, Hengartner H, Von der Weid N, Renella R. Diagnosis and management of iron deficiency in children with or without anemia: consensus recommendations of the SPOG Pediatric Hematology Working Group. Eur J Pediatr. 2020;179:527-45. https://doi.org/10.1007/s00431-020-03597-5
- Neef V, Schmitt E, Bader P, Zierfuß F, Hintereder G, Steinbicker AU, et al. The reticulocyte hemoglobin equivalent as a screening marker for iron deficiency and iron deficiency anemia in children. J Clin Med. 2021;10:3506. https://doi.org/10.3390/jcm10163506
- Chandra J, Dewan P, Kumar P, Mahajan A, Singh P, Dhingra B, et al. Diagnosis, treatment and prevention nutritional anemia in children: Recommendations of the Joint Committee of Pediatric Hematology-Oncology Chapter and Pediatric and Adolescent Nutrition Society of the Indian Academy of Pediatrics. Indian Pediatr. 2022;59:782-801.
- Sermini CG, Acevedo MJ, Arredondo M. Biomarkers of metabolism and iron nutrition. Rev Peru Med Exp Salud Publica. 2017;34:690-8. https://doi.org/10.17843/rpmesp.2017.344.3182
- Moscheo C, Licciardello M, Samperi P, La Spina M, Di Cataldo A, Russo G. New Insights into Iron Deficiency Anemia in Children: A Practical Review. Metabolites. 2022;12:289. https://doi.org/10.3390/metabo12040289
- Yu KH. Effectiveness of zinc protoporphyrin/heme ratio for screening iron deficiency in preschool-aged children. Nutr Res Pract. 2011;5(1):40-5. https://doi.org/10.4162/nrp.2011.5.1.40
- El Gendy FM, El-Hawy MA, Shehata AMF, Osheba HE. Erythroferrone and iron status parameters levels in pediatric patients with iron deficiency anemia. Eur J Haematol. 2018;100(4):356-60. https://doi.org/10.1111/ejh.13021
- García Casal MN, Pasricha SR, Martínez RX, López Pérez l, Peña Rosas JP. Serum or plasma ferritin concentration as an index of iron deficiency and overload. Cochrane Database of Systematic Reviews. 2021;5:CD011817. https://doi.org/10.1002/14651858.CD011817.pub2
- Mei Z, Addo OY, Jefferds ME, Sharma AJ, Flores-Ayala RC, Brittenham GM. Physiologically based serum ferritin thresholds for iron deficiency in children and non-pregnant women: a US National Health and Nutrition Examination Surveys (NHANES) serial cross-sectional study. Lancet Haematol. 2021;8(8):e572-82. https://doi.org/10.1016/S2352-3026(21)00168-X
- Parkin PC, Koroshegyi C, Mamak E, Borkhoff CM, Birken CS, Maguire JL, et al. Association between Serum Ferritin and Cognitive Function in Early Childhood. J Pediatr. 2020;217:189-191.e2. https://doi.org/10.1016/j.jpeds.2019.09.051
- Mukhtarova N, Ha B, Diamond CA, Plumb AJ, Kling PJ. Serum Ferritin Threshold for Iron Deficiency Screening in One-Year-Old Children. J Pediatr. 2022;245:217-21. https://doi.org/10.1016/j.jpeds.2022.01.050
- Fletcher A, Forbes A, Svenson N, Wayne Thomas D. Guideline for the laboratory diagnosis of iron deficiency in adults (excluding pregnancy) and children. Br J Haematol. 2022;196(3):523-9. https://doi.org/10.1111/bjh.17900
- Jullien S. Screening of iron deficiency anaemia in early childhood. BMC Pediatr. 2021;21(1):337. https://doi.org/10.1186/s12887-021-02725-w
- Hennig G, Homann C, Teksan I, Hasbargen U, Hasmüller S, Holdt LM, et al. Non-invasive detection of iron deficiency by fluorescence measurement of erythrocyte zinc protoporphyrin in the lip. Nat Commun. 2016;7:10776. https://doi.org/10.1038/ncomms10776
- Oshin O, Kireev D, Hlukhova H, Idachaba F, Akinwande D, Atayero A. Graphene-based biosensor for early detection of iron deficiency. Sensors (Switzerland). 2020;20(13):3688. https://doi.org/10.3390/s20133688
- Georgieff MK. Iron assessment to protect the developing brain. Am J Clin Nutr. 2017;106(Suppl 6):1588S-93S. https://doi.org/10.3945/ajcn.117.155846
- Lozoff B. Iron deficiency and child development. Food Nutr Bull. 2007;28(4):S560-71. https://doi.org/10.1177/15648265070284S409
- Lozoff B, Smith JB, Kaciroti N, Clark KM, Guevara S, Jimenez E. Functional significance of early-life iron deficiency: Outcomes at 25 years. J Pediatr. 2013;163(5):1260-6. https://doi.org/10.1016/j.jpeds.2013.05.015
- Doom JR, Gahagan S, Caballero G, Encina P, Lozoff B. Infant iron deficiency, iron supplementation, and psychosocial stress as predictors of neurocognitive development in Chilean adolescents. Nutr Neurosci. 2021;24(7):520-9. https://doi.org/10.1080/1028415X.2019.1651105
- Akman M, Cebeci D, Okur V, Angin H, Abali O, Akman AC. The effects of iron deficiency on infants’ developmental test performance. Acta Paediatr. 2004;93:1391-6.
- Wang B, Zhan S, Gong T, Lee l. Iron therapy for improving psychomotor development and cognitive function in children under the age of three with iron deficiency anaemia. Cochrane Database of Systematic Reviews. 2013;2013(6):CD001444. https://doi.org/10.1002/14651858.CD001444.pub2
- McDonagh MS, Blazina I, Dana T, Cantor A, Bougatsos C. Screening and routine supplementation for iron deficiency anemia: A systematic review. Pediatrics. 2015;135:723-33. https://doi.org/10.1542/peds.2014-3979
- Kemper AR, Fan T, Grossman DC, Phipps MG. Gaps in evidence regarding iron deficiency anemia in pregnant women and young children: summary of US Preventive Services Task Force recommendations. Am J Clin Nutr. 2017;106(6):1555-8. https://org/10.3945/ajcn.117.155788
- Pasricha SR, Hasan MI, Braat S, Larson LM, Tipu SMMU, Hossain SJ, et al. Benefits and Risks of Iron Interventions in Infants in Rural Bangladesh. N Engl J Med. 2021;385(11):982-95. https://doi.org/10.1056/NEJMoa2034187
- Hua M, Shi D, Xu W, Zhu l, Hao X, Zhu B, et al. Differentiation between fetal and postnatal iron deficiency in altering brain substrates of cognitive control in pre-adolescence. BMC Med. 2023;21:167. https://org/10.1186/s12916-023-02850-6
- Svensson l, Chmielewski G, Czyzewska E, Domellöf M, Konarska Z, Piescik-Lechet M, et al. Effect of low-dose iron supplementation on early development in breastfed infants: a randomized clinical trial. JAMA Pediatr. 2024;178(7):649-56. https://doi.org/10.1001/jamapediatrics.2024.1095
- Carsley S, Fu R, Borkhoff CM, Reid N, Baginska E, Birken CS, et al. Iron deficiency screening for children at 18 months: a cost-utility analysis. CMAJ Open. 20191;7(4):E689-98. https://doi.org/10.9778/cmajo.20190084
- REGLAMENTO DELEGADO (UE) 2016/ 127 DE LA COMISIÓN - de 25 de septiembre de 2015 - que complementa el Reglamento (UE) no 609/ 2013 del Parlamento Europeo y del Consejo en lo que respecta a los requisitos específicos de composición e información aplicables a los preparados para lactantes y preparados de continuación, así como a los requisitos de información sobre los alimentos destinados a los lactantes y niños de corta edad. En: BOE [en línea] [consultado el 29/05/2025]. Disponible en boe.es/doue/2016/025/L00001-00029.pdf
- Domellöf M, Braegger C, Campoy C, Colomb V, Decsi T, Fewtrell M, et al; ESPGHAN Committee on Nutrition. Iron requirements of infants and toddlers. J Pediatr Gastroenterol Nutr. 2014;58(1):119-29. https://doi.org/10.1097/MPG.0000000000000206
- Pallás Alonso C, García González P, Jiménez Moya A, Loureiro González B, Martín Peinador Y, Soriano Faura J, et al. Protocolo de seguimiento para el recién nacido menor de 1.500 g o menor de 32 semanas de edad gestación. An Pediatr (Barc). 2018;88:229.e1-229.e10 https://doi.org/10.1016/j.anpedi.2017.12.010
- García Reymundo MG, Hurtado Suazo JA, Calvo Aguilar MJ, Soriano Faura FJ, Ginovart Galiana G, Martín Peinador Y, et al. Recomendaciones de seguimiento del prematuro tardío, 2019. Sociedad Española de Neonatología. An Pediatr (Barc). 2019;90(5):310.e1-318.e8 https://doi.org/10.1016/j.anpedi.2019.01.008





